
已知2A(g)+B(g)  2C(g),向容积为1 L的密闭容器中加入0.050 mol A和0.025 mol B,在500℃时充分反应,达平衡后测得c(C)=0.040 mol·L-1,放出热量Q1kJ。
2C(g),向容积为1 L的密闭容器中加入0.050 mol A和0.025 mol B,在500℃时充分反应,达平衡后测得c(C)=0.040 mol·L-1,放出热量Q1kJ。
(1)能说明上述反应已经达到化学平衡状态的是 (填写序号);
a.v(C)=2v(B) b.容器内压强保持不变
c.v逆(A)=2v正(B) d.容器内气体的密度保持不变
(2)若在相同的容器中只加入0.050 mol C,500℃时充分反应达平衡后,吸收热量Q2kJ,则Q1与Q2之间的关系式可表示为 (用含Q1、Q2的代数式表示);
(3)500℃时,上述反应的化学平衡常数K= ;
(4)已知:K(300℃)>K(350℃),该反应是 (填“放”或“吸”)热反应;若反应温度升高,A的转化率 (填“增大”“减小”或“不变”);
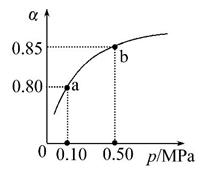
(5)某温度下,A的平衡转化率(α)与体系总压强(p)的关系如图所示,平衡状态由a变到b时,化学平衡常数K(a) K(b)(填“>”“<”或“=”)。
【解析】(1)该反应是气体体积减小的放热反应,容器体积不变,当压强不发生变化时,说明反应已达平衡,b正确,由反应速率和物质化学计量数的关系知v(C)=2v(B),v(A)=2v(B),故a不能作为平衡的依据,但v逆(A)=2v正(B)时,说明反应已达平衡。
(2)由化学平衡的特点知加入0.050 mol C与加入0.050 mol A和0.025 mol B的平衡状态是等同的,正反应时生成了0.040 mol C,则逆反应时分解的C只有0.010 mol,故Q1应是Q2的4倍,即Q1=4Q2。
(3)500℃时反应的平衡常数:K=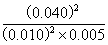 =3 200
=3 200
(4)温度升高,平衡常数减小,平衡逆向移动,说明该反应是放热反应。所以升高温度,A的转化率减小。
(5)平衡常数只受温度的影响,温度不变,平衡常数不变。
答案:(1)bc (2)Q1=4Q2 (3)3 200 (4)放 减小 (5)=


科目:高中化学 来源: 题型:
A、B、C、D、E、F六种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B与C为同一周期,D与F为同一周期,A与D、C与F分别为同一主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的元素。又知六种元素所形成的常见单质在常温压下有三种是气体,三种是固体。
请回答下列问题:
(1) 工业上用A和B的单质化合制备化合物X,该反应的化学方程式
(2)若E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式: 。
(3)若D、E、F的最高价氧化物的水化物两两能发生反应,则E的最高价氧化物的水化物与D的最高价氧化物的水化物反应的离子方程式
(4)用电子式表示化合物D2F的形成过程 。
(5)由A、B、C三种元素组成的化合物X中共含有9个原子,X中所含化学键类型有
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于平衡常数的说法正确的是( )
A.在平衡常数表达式中,反应物浓度用起始浓度,生成物浓度用平衡浓度
B.在任何条件下,化学平衡常数是一个恒定值
C.平衡常数的大小与温度、浓度、压强、催化剂等无关
D.从平衡常数的大小可以推断一个反应进行的程度
查看答案和解析>>
科目:高中化学 来源: 题型:
化学平衡常数K的数值大小是衡量化学反应进行程度的标志,在常温下,下列反应的平衡常数的数值如下:
2NO(g) N2(g)+O2(g) K1=1×1030
N2(g)+O2(g) K1=1×1030
2H2(g)+O2(g) 2H2O(g) K2=2×1081
2H2O(g) K2=2×1081
2CO2(g) 2CO(g)+O2(g) K3=4×10-92
2CO(g)+O2(g) K3=4×10-92
以下说法正确的是( )
A.常温下,NO分解产生O2的反应的平衡常数表达式为K1=c(N2)·c(O2)
B.常温下,水分解产生O2,此时平衡常数的数值约为5×10-80
C.常温下,NO、H2O、CO2三种化合物分解放出O2的倾向由大到小的顺序为NO>H2O>CO2
D.以上说法都不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是 ( )
A.Na2CO3溶液显碱性: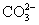 +2H2O
+2H2O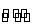 H2CO3+2OH-
H2CO3+2OH-
B.碳酸氢钠溶液中加入足量的烧碱溶液: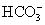 +OH-====
+OH-====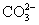 +H2O
+H2O
C.金属钠与水反应:Na+H2O====Na++OH-+H2↑
D.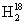 O中投入Na2O2:2
O中投入Na2O2:2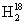 O+2Na2O2====4Na++4OH-+18O2↑
O+2Na2O2====4Na++4OH-+18O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
现有一定量含有Na2O杂质的Na2O2试样,用下图所示的实验装置测定Na2O2试样的纯度。(可供选用的试剂只有CaCO3固体、6 mol·L-1盐酸、6 mol·L-1硫酸和蒸馏水)
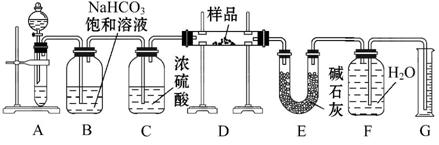
回答下列问题:
(1)装置A中液体试剂选用 ,理由是 ____________________________。
(2)装置B的作用是 _________________________________________________,
装置E中碱石灰的作用是 ____________________________________________。
(3)装置D中发生反应的化学方程式是 ________,_________________。
(4)若开始时测得样品的质量为2.0 g,反应结束后测得气体体积为224 mL(标准状况),则Na2O2试样的纯度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
近期,世界范围内有成千上万个湖泊变为鱼类绝迹的死湖,数以千万公顷计的森林衰败枯萎,大片土地沙漠化……将这些现象与频繁降落的酸雨相联系,人们认为,酸雨是肇事主因。某研究小组研究某地硫酸型酸雨的形成,有人提出以下猜想:
猜想一:SO2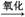 SO3
SO3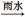 H2SO4
H2SO4
猜想二:SO2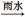 H2SO3
H2SO3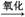 H2SO4
H2SO4
猜想三:以上两过程同时存在
有关上述猜想,收集一定量该地区刚下的雨水进行实验,下列判断中错误的是
( )
A.若猜想一或猜想三正确,则该雨水加入盐酸后,再加入BaCl2溶液,有白色沉淀生成
B.若存在猜想二的过程,则该雨水可能使品红溶液褪色
C.若只存在猜想一的过程,则该雨水的pH随时间延长而增大
D.上述任意一个猜想正确,该地区雨水的pH均小于5.6
查看答案和解析>>
科目:高中化学 来源: 题型:
对于短周期元素,下列说法正确的是( )
A.若两元素原子序数相差8,则周期数一定相差1
B.两种简单离子不可能相差3个电子层
C.同族的两元素之间不可能形成化合物 D.最外层电子数相同的微粒一定位于同一族
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com