
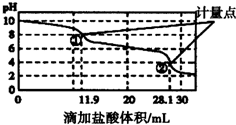
| A. | 此样品n(NaHCO3)=(28.1-11.9)×10-4mol | |
| B. | 计量点②溶液中大量存在的阴离子是Cl- | |
| C. | 计量点①-②之间发生反应的离子方程式为HCO3-+H+═H2O+CO2↑ | |
| D. | 使用该方法测定Na2CO3和NaOH混合溶液中的NaOH含量,将会得到1个计量点 |
分析 A.向混合溶液中滴加稀盐酸时,发生反应的离子方程式先后顺序是CO32-+H+═HCO3-、HCO3-+H+═H2O+CO2↑,根据图知,0-11.9mL时发生的反应为CO32-+H+═HCO3-、11.9-28.1mL时发生的反应为HCO3-+H+═H2O+CO2↑,11.9mL-28.1mL发生反应的NaHCO3包含原来的和Na2CO3转化的,据此计算样品n(NaHCO3);
B.溶液pH=4,显示酸性,溶液中溶质为NaCl、H2CO3;
C.计量点①-②之间是NaHCO3和稀盐酸的反应;
D.Na2CO3和NaOH混合溶液中滴加稀盐酸,反应先后顺序依次是NaOH、Na2CO3、NaHCO3.
解答 解:A.向混合溶液中滴加稀盐酸时,发生反应的离子方程式先后顺序是CO32-+H+═HCO3-、HCO3-+H+═H2O+CO2↑,根据图知,0-11.9mL时发生的反应为CO32-+H+═HCO3-、11.9-28.1mL时发生的反应为HCO3-+H+═H2O+CO2↑,11.9mL-28.1mL发生反应的NaHCO3包含原来的和Na2CO3转化的,根据HCO3-+H+═H2O+CO2↑知,样品n(NaHCO3)=n(HCl)=(28.1-11.9)×10-3L×0.01mol/L×10=(28.1-11.9)×10-4mol,故A正确;
B.溶液pH=4,显示酸性,溶液中溶质为NaCl、H2CO3,则计量点②溶液中大量存在的阴离子是Cl-,故B正确;
C.计量点①-②之间是NaHCO3和稀盐酸的反应,离子方程式为HCO3-+H+═H2O+CO2↑,故C正确;
D.Na2CO3和NaOH混合溶液中滴加稀盐酸,反应先后顺序依次是NaOH、Na2CO3、NaHCO3,所以应该有3个计量点,故D错误;
故选D.
点评 本题考查混合物的计算,为高频考点,侧重考查学生分析计算及图象分析能力,正确理解图象中曲线变化趋势与发生的反应关系是解本题关键,知道各个拐点溶液中溶质成分,题目难度中等.


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:解答题
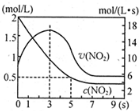 氮及其化合物在工业生产和国防建设中有广泛应用.回答下列问题:
氮及其化合物在工业生产和国防建设中有广泛应用.回答下列问题: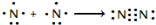 .
.| 化学键 | N-H | N-N | N=N | N≡N | O=O | O-H |
| 键能(kJ/mol) | 390.8 | 193 | 418 | 946 | 497.3 | 462.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用固体氢氧化钠配制标准溶液时其中混有Na2O杂质 | |
| B. | 滴定终点读数时,俯视滴定管的刻度,其它操作均正确 | |
| C. | 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗 | |
| D. | 滴定到终点读数时发现碱式滴定管尖嘴处悬挂一滴溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
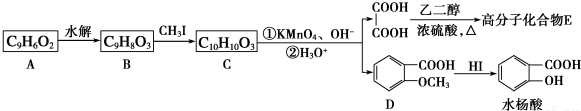
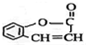 .
.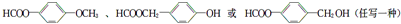 .
.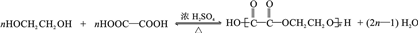 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+<Mg2+<Al3+<O2- | B. | S2->Cl->Na+>Al3+ | ||
| C. | Na<Mg<Al<S | D. | Cs<Rb<K<Na |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,33.6L氟化氢中含有氟原子数目为1.5NA个 | |
| B. | 1 molNa2O2与足量CO2反应,转移的电子数为2NA个 | |
| C. | 1L,1mol/L CH3COOH溶液中,所含CH3COO-、CH3COOH的总数为NA个 | |
| D. | 6.0g SiO2晶体中含有0.1NA个SiO2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X:澄清石灰水,Y:二氧化硫 | B. | X:漂白粉溶液,Y:二氧化硫 | ||
| C. | X:氢氧化钡溶液,Y:二氧化碳 | D. | X:偏铝酸钠溶液,Y:二氧化氮 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作及现象 | 结论 | |
| A | 将铜粉加入1.0mol•L-1Fe2(SO4)3溶液中,溶液变蓝 | 金属铁比铜活泼 |
| B | 向某溶液中滴加氯水后再加入KSCN溶液,溶液呈红色 | 溶液中一定含有Fe2+ |
| C | 向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色. | Br-还原性强于Cl- |
| D | 加热盛有NH4Cl固体的试管,试管底部固体消失,试管口有晶体凝结. | NH4Cl固体可以升华 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com