
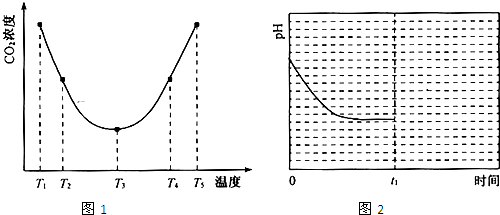
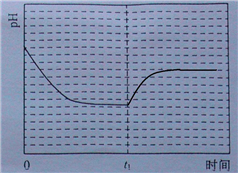
 ;
; 


科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 催化剂 |
| 加热 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 催化剂 |
| △ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Fe3O4+4CO═3Fe+4CO2/△H=-14kJ?mol-1 |
| B.Fe3O4(s)+4CO(g)═3Fe(s)+4CO2(g)△H=-22kJ?mol-1 |
| C.Fe3O4(s)+4CO(g)═3Fe(s)+4CO2(g)△H=+14kJ?mol-1 |
| D.Fe3O4(s)+4CO(g)═3Fe(s)+4CO2(g)△H=-14kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.与NaOH反应时,HCl的中和热小于CH3COOH的中和热 |
| B.与NaOH反应时,HCl的中和热大于CH3COOH的中和热 |
| C.与NaOH反应时,H2SO4的中和热大于HCl的中和热 |
| D.与H2SO4反应时,Ba(OH)2的中和热等于NaOH的中和热的2倍 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.在0.10 mol·L-1 NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-)+c(CO ) ) |
| B.甲烷的标准燃烧热是890.3 kJ·mol-1,则甲烷燃烧的热化学方程式是: CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3 kJ·mol-1 |
| C.用铜作电极电解CuSO4溶液:2Cu2++2H2O 电解 2Cu+O2↑+4H+ |
| D.以KOH为电解质溶液的甲醇燃料电池的负极电极反应式: |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
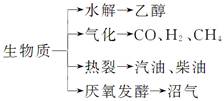
| A.①②③④⑤ | B.①②④⑤ |
| C.③④⑤ | D.①②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com