
| A. | 一定条件下,将1molN2和3molH2混合,充分反应后转移的电子数为NA | |
| B. | 1.5molNO2与足量水反应,转移的电子数为1.5NA | |
| C. | 6.4g由S2、S4、S8组成的混合物含硫原子数为0.2NA | |
| D. | 常温常压下,11.2LCl2含氯原子数为NA |
分析 A.合成氨的反应为可逆反应,题中数据无法计算生成氨气的物质的量,则无法计算转移的电子数;
B.二氧化氮与水反应生成NO气体和硝酸,1.5mol二氧化氮完全反应生成NO的物质的量为:1.5mol×$\frac{1}{3}$=0.5mol,转移电子的物质的量为:0.5mol×(4-2)=1mol;
C.6.4g混合物中含有6.4gS原子,含有0.2molS原子;
D.常温常压下,不能使用标况下的气体摩尔体积计算氯气的物质的量.
解答 解:A.由于合成氨的反应为可逆反应,氮气和氢气不可能完全转化成生成物,题中数据无法判断氨气的物质的量,则无法计算反应中转移的电子数,故A错误;
B.1.5molNO2与足量水反应生成NO和硝酸,生成NO的物质的量为:1.5mol×$\frac{1}{3}$=0.5mol,转移电子的物质的量为:0.5mol×(4-2)=1mol,转移的电子数为NA,故B错误;
C.6.4g由S2、S4、S8组成的混合物中含有6.4g硫原子,含硫原子的物质的量为:$\frac{6.4g}{32g/mol}$=0.2mol,含有的硫原子数为0.2NA,故C正确;
D.不是标况下,不能使用标况下的气体摩尔体积计算,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的计算和判断,题目难度中等,注意明确标况下气体摩尔体积的使用条件,熟练掌握物质的量与阿伏伽德罗常数、摩尔质量等物理量之间的关系,A为易错点,注意可逆反应特点.


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | Y的最高价氧化物的熔点比X的最高价氧化物的熔点低 | |
| B. | 原子半径:Y>Z>X | |
| C. | Y的最高价氧化物的水化物只能与酸反应,不能与碱反应 | |
| D. | 由Z、Y两元素分别形成的单质均存在同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
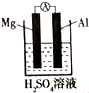 (普)实验探究:为了研究同周期元素性质递变规律,某同学自己设计了一套实验方案,并动手记录实验步骤和现象如下:(表中的“实验步骤”与“实验现象”前后不一定是对应关系)
(普)实验探究:为了研究同周期元素性质递变规律,某同学自己设计了一套实验方案,并动手记录实验步骤和现象如下:(表中的“实验步骤”与“实验现象”前后不一定是对应关系) | 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色. |
| ②在盛有冷水的烧杯中滴入几滴酚酞溶液,再将一小块金属钠放入其中 | B.有气体产生,溶液变成浅红色 |
| ③将镁条投入稀盐酸中 | C.剧烈反应,迅速产生大量无色气体 |
| ④将铝条投入稀盐酸中 | D.不十分剧烈,产生无色气体 |
| ⑤向AlCl3溶液中滴加NaOH溶液至过量 | E.生成白色胶装沉淀,继而沉淀消失 |
| 实验内容 | ① | ② | ③ | ④ | ⑤ |
| 实验现象(填A-E) | B |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
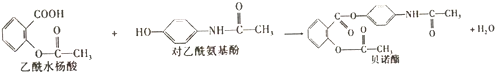
| A. | 根据有机物的分类,乙酰水杨酸也属于芳香烃 | |
| B. | 可用FeCl3溶液区别乙酰水杨酸和对乙酰氨基酚 | |
| C. | 乙酰水杨酸和对乙酰氨基酚均能与NaHCO3溶液反应 | |
| D. | 1mol乙酰水杨酸最多能与2molNaOH发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
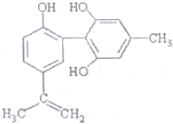 我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂,某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )
我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂,某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )| A. | 该物质与苯酚属于同系物,遇FeCl3溶液呈紫色 | |
| B. | 滴入酸性KMnO,溶液振荡,紫色褪去,能证明其结构中存在碳碳双键 | |
| C. | 该物质的分子式为C14H28O3 | |
| D. | lmol该物质分别与浓溴水和H2反应时,最多消耗Br3和H2分别为4mol和7mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 1 | 2 | 3 | 4 | 5 | 6 | … |
| CH4O | C2H6O | C3H8O | C5H12O | C6H14O | … |
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
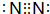 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com