
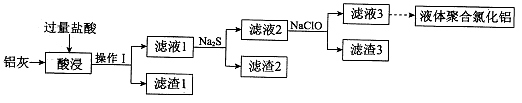


 ”得分)(1分)
”得分)(1分)

科目:高中化学 来源:不详 题型:填空题
| 物质 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀时 | 1.5 | 3.4 | 6.3 |
| 完全沉淀时 | 2.8 | 4.7 | 8.3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.向某溶液中加稀盐酸,将产生的无色气体通入澄清石灰水中,石灰水变浑浊,则原溶液中一定有CO32-或HCO3- |
| B.向某溶液中加入硝酸钡溶液有白色沉淀产生,再加稀盐酸,沉淀不消失,则原溶液中一定有SO42- |
| C.向某溶液中加入浓氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,则原溶液中存在NH4+ |
| D.向某溶液中加入硝酸银溶液产生白色沉淀,再加稀盐酸,沉淀不消失,则原溶液中一定有Cl- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 物质 | 使用的试剂 | 主要操作 |
| A | 乙醇(水) | 金属钠 | 过滤 |
| B | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 分液 |
| C | 苯(苯酚) | 浓溴水 | 振荡、分液 |
| D | 乙烷(乙烯) | 酸性高锰酸钾溶液 | 冼气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加快碘元素与水反应的速率 | B.使溶液浓缩 |
| C.使空气中的氧气更多地进入溶液 | D.加速碘化物的溶解 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
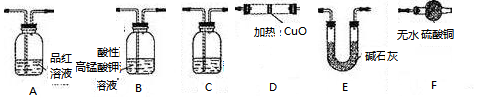
| A.① | B.②③④ | C.①②⑤ | D.③④⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用加入过量氨水并过滤的方法除去NaCl溶液中混有的AlCl3 |
| B.除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤后,分液 |
| C.除去CO2中少量的HCl:气体通过盛有NaOH溶液的洗气瓶 |
| D.除去FeCl3溶液中少量的CuCl2:用足量铁粉,过滤 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com