
向50 mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10 mL,将其稀释至100 mL,并向此稀释后的溶液中逐滴加入0.1 mol·L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图所示。
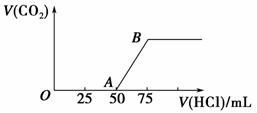
(1)写出OA段所发生反应的离子方程式:________________________________________________________________________。
(2)NaOH在吸收CO2后,所得溶液的溶质为________________________________________________________________________,
其物质的量浓度之比为________。
(3)产生的CO2体积(标准状况下)为________________________________________________________________________。
(4)原NaOH溶液的物质的量浓度为________。
解析 将CO2通入NaOH溶液中,可能发生两个反应:CO2+2NaOH===Na2CO3+H2O,Na2CO3+CO2+H2O===2NaHCO3,所以反应后的溶液中溶质有四种可能:NaOH和Na2CO3、Na2CO3、Na2CO3和NaHCO3、NaHCO3。
(1)在Na2CO3溶液中逐滴加入盐酸,反应的过程是Na2CO3+HCl===NaHCO3+NaCl、NaHCO3+HCl===NaCl+H2O+CO2↑。
只有当Na2CO3全部转化为NaHCO3后,滴入盐酸才会产生CO2。从图像中可以看出,与NaHCO3反应的HCl为n(HCl)=0.1 mol·L-1×(75-50)×10-3L=0.002 5 mol,所以溶液中的Na2CO3也为0.002 5 mol,将Na2CO3转化为NaHCO3需消耗盐酸25 mL,所以开始加入的25 mL盐酸应是用来中和NaOH的。
(2)所得溶液的溶质为NaOH和Na2CO3。
n(Na2CO3)=n(NaHCO3)=0.1 mol·L-1×(75-50)×10-3L=0.002 5 mol
n(NaOH)=0.1 mol·L-1×25×10-3L=0.002 5 mol
(3)n(CO2)=n(Na2CO3)=0.002 5 mol
V(CO2)=22.4 L· mol-1×0.002 5 mol=0.056 L
(4)取出的10 mL溶液中含Na+的物质的量为n(Na+)=n(NaOH)+2n(Na2CO3)=0.002 5 mol+2×0.002 5 mol=0.007 5 mol
原NaOH溶液(50 mL)的物质的量浓度为c(NaOH)=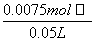 =0.75 mol·L-1。
=0.75 mol·L-1。
答案 (1)H++OH-===H2O;CO +H+===HCO
+H+===HCO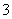
(2)NaOH和Na2CO3 1∶1 (3)0.056 L
(4)0.75 mol·L-1


科目:高中化学 来源: 题型:
在等温等容条件下,可逆反应:2A(g)+B(g)3C(g)+D(s)起始物质的量如下表所示:
| 序号 | A | B | C | D |
| ① | 2 mol | 1 mol | 0 | 0 |
| ② | 4 mol | 2 mol | 0 | 0 |
| ③ | 1 mol | 0.5 mol | 1.5 mol | 0.5 mol |
| ④ | 0 | 1 mol | 3 mol | 1 mol |
| ⑤ | 0 | 0 | 3 mol | 1 mol |
上述反应达到平衡时,互为等效平衡的是哪几组?达到平衡后,哪些量相同?
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关金属的说法中,不正确的是( )
A.青铜、不锈钢、硬铝都是合金
B.铜表面易形成致密的氧化膜
C.工业上用电解熔融MgCl2的方法制取金属镁
D.铝是活泼金属,但在空气中耐腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O26SO2+Fe3O4,有3 mol FeS2参加反应,转移________mol电子。
(2)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为________________________________________________________________________;
从腐蚀废液回收得到金属铜,还需要的试剂是________。
 (3)与明矾相似,硫酸铁也可用作净水剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是________________________________________________________________________。
(3)与明矾相似,硫酸铁也可用作净水剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是________________________________________________________________________。
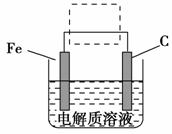
(4)钢铁的电化腐蚀原理如图所示,将该图稍作修改即可成为钢铁电化学防护的简单示意图,请在图中虚线框内作出修改,并用箭头标出电子流动方向。
查看答案和解析>>
科目:高中化学 来源: 题型:
有关Na2CO3和NaHCO3的性质,下列叙述中错误的是( )
A.相同温度下,等浓度的Na2CO3溶液和NaHCO3溶液的碱性比较,前者更强
B.常温时水溶性:Na2CO3>NaHCO3
C.在酒精灯加热的条件下,前者不分解,后者分解
D.将澄清的石灰水分别加入Na2CO3和NaHCO3溶液中,前者产生沉淀,后者不产生沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5。若忽略水的电离及H2CO3的第二级电离,则H2CO3??HCO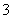 +H+的平衡常数K1=________。(已知:10-5.60=2.5×10-6)
+H+的平衡常数K1=________。(已知:10-5.60=2.5×10-6)
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如右图所示。据图判断正确的是( )

A.Ⅱ为盐酸稀释时的pH值变化曲线
B.b点溶液的导电性比c点溶液的导电性强
C.a点Kw的数值比c点Kw的数值大
D.b点酸的总浓度大于a点酸的总浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室需要纯净的NaCl溶液,但现有的NaCl晶体混有少量Na2SO4和(NH4)2CO3,请设计实验除去杂质,并回答下列问题:
(1)除去(NH4)2CO3用加热好还是加强碱后再进行加热好?
你选择的是________,其理由是_____________________________。
判断(NH4)2CO3已除尽的方法是_____________________________。
(2)除去SO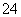 的方法是___________________________________
的方法是___________________________________
________________________________________________________________________。
判断SO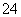 已除尽的方法是______________________________________
已除尽的方法是______________________________________
________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com