
| A. | 4molA+2molB | B. | 1.5molC+0.5molD | ||
| C. | 1molB+1molD | D. | 1molA+0.5molB+1.5molC+0.5molD |
分析 恒温恒容条件下,反应2A(g)+B(g)?3C(g)+D(g)前后气体物质的量不同,若要平衡时C的浓度仍为W mol/L,利用极端假设法计算,需使反应物仍为2mol A和1mol B,据此分析.
解答 解:A、加入4molA+2molB,平衡后C的浓度大于Wmol/L,故A错误;
B、加入1.5molC+0.5molD,相当于加入1molA和0.5molB,平衡后C的浓度小于Wmol/L,故B错误;
C、加入1molB和1molD,反应不能发生,故C错误;
D、加入1molA+0.5molB+1.5molC+0.5molD,利用极端假设法计算,相当于加入2mol A和1mol B,平衡时C的浓度仍为W mol/L,故D正确;
故选D.
点评 本题考查了等效平衡的相关计算,注意极端假设法的应用,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol K2O2中含有的阴、阳离子总数是4NA | |
| B. | 0.2molO3与6.72LO2均含有0.6NA个氧原子 | |
| C. | 常温常压下,22g P4O6与P4O10的混合物中含有氧原子的数目为0.6NA | |
| D. | 10gD216O所含的中子数为5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| 选项 | X | Y | Z | M |
| A | O2 | CO2 | CO | C |
| B | CH3CH2OH | CH3CHO | CH3COOH | O2 |
| C | NaOH | NaHCO3 | Na2CO3 | CO2 |
| D | NH3 | NO | NO2 | O2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28g乙烯和聚乙烯完全燃烧生成的CO2分子数均为2NA | |
| B. | 25℃时,pH=3的1.0L NaHSO3溶液中,含Na+数目为0.001NA | |
| C. | 2.24LNH3中含共价键数目为0.3 NA | |
| D. | 78g苯含有C=C双键的数目为3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 负极反应为O2+2H2O+4e-=4OH- | |
| B. | 放电时正极发生氧化反应,外电路中电子从正极流向负极 | |
| C. | 负极反应为CH4+10OH--8e-=CO32-+7H2O | |
| D. | 随着放电的进行,溶液的pH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
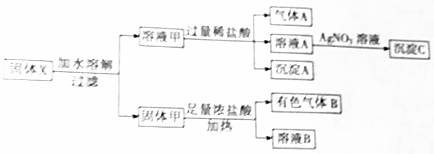
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
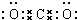 .
.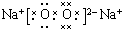 ,其存在的化学键是离子键和非极性键
,其存在的化学键是离子键和非极性键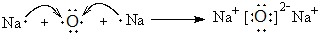 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com