
常温下,在下列给定条件的各溶液中,一定能大量共存的离子组是
A.使酚酞试液变红色的溶液:Na+、Ba2+、I-、Cl-
B.使甲基橙变红色的溶液:Ca2+、K+、HCO3-、Cl-
C.含有0.1 mol·L-1 Fe(NO3)2的溶液:H+、Mg2+、SCN-、Cl-
D.由水电离产生的c(H+)=10-13mol·L-1的溶液:NH4+、SO42-、NO3-、Cl-
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
一定温度下,在容积为V L的密闭容器中进行反应:aN(g)bM(g),M、N的物质的量随时间的变化曲线如图所示:
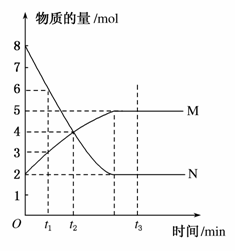
(1)此反应的化学方程式中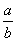 =________。
=________。
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为______________________________________________________。
(3)下列叙述中能说明上述反应达到平衡状态的是________。
A.反应中M与N的物质的量之比为11
B.混合气体的总质量不随时间的变化而变化
C.混合气体的总物质的量不随时间的变化而变化
D.单位时间内每消耗a mol N,同时生成b mol M
E.混合气体的压强不随时间的变化而变化
F.N的质量分数在混合气体中保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
铜和稀硝酸在常温常压下反应,开始时反应非常慢,但是随着反应的进行,反应速率不断地加大。某校合作学习小组的同学拟探究影响其速率的主要因素。
(1) Cu与稀硝酸反应的离子方程式_ 。
(2)甲同学认为是生成的Cu2+对该反应起催化作用,欲验证其假设是否正确,其实验方法是:_ _ 。
(3)乙同学依据铜和硝酸是放热反应,拟研究温度升高是否为该反应速度率不断加大的主要原因,实验结果如下:
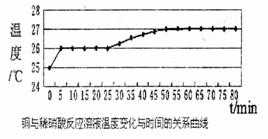
由此可得到的结论是_ _ 。
(4)丙同学查阅文献,得知稀硝酸与铜反应,还原产物起始也是NO2,NO2对该反应起催化作用。通过下列装置验证:
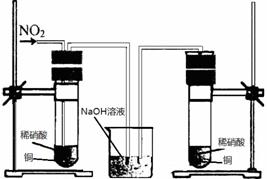
实验发现左侧3min后开始大量产生气泡,右侧40min内无明显变化。
①氢氧化钠溶液的作用是_ _ 。
②该学生设计在左侧加的是2mol·L-1 HNO3溶液,右侧加的是2.2 mol·L-1 硝酸。左侧浓度稍偏小,这样设计主要是考虑到_ 。
(5)丁同学与丙同学交流后,他将实验改进为:在试管中加入3mL2mol·L-1 HNO3并放入铜片,然后加入几粒NaNO2晶体,发现只需1秒钟,铜片表面就开始产生气泡。由丁的实验推断出的可能结论是:_ _ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在Al2(SO4)3和(NH4)2SO4的混合溶液中,逐滴加入NaOH溶液至过量。下列图示能正确表示生成沉淀的质量与滴入NaOH溶液体积关系的是( )
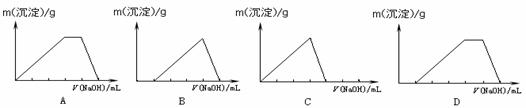
查看答案和解析>>
科目:高中化学 来源: 题型:
某混合物的水溶液,可能含有以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、NH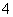 、Cl-、CO
、Cl-、CO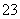 、SO
、SO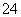 ,现分别取100 mL的两等份溶液进行如下实验:
,现分别取100 mL的两等份溶液进行如下实验:
①第一份加过量NaOH溶液后加热,收集到0.02 mol气体,无沉淀生成,同时得到溶液甲。
②向甲溶液中通入过量CO2生成白色沉淀,沉淀经过滤、洗涤、干燥、灼烧后,得到1.02 g固体。
③第二份加足量BaCl2溶液后,生成白色沉淀,沉淀经足量盐酸洗涤、干燥后,得到11.65 g固体。
依据实验回答下列问题:
(1)综合以上实验,该混合物的水溶液中一定不存在的离子是 (填离子符号)。
(2)写出②中产生沉淀的离子方程式 。
(3)某同学通过分析认为该溶液中K+一定 (填“存在”或“不存在”),他的理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
图示中的四种物质W、X、Y、Z,能按箭头方向一步转化的有
| W | X | Y | Z |
| |
| ① | Na | NaOH | Na2CO3 | NaCl | |
| ② | Al(OH)3 | Al2O3 | Al | NaAlO2 | |
| ③ | SO2 | (NH4)2SO3 | NH4HSO3 | Na2SO3 | |
| ④ | FeCl2 | Fe | FeSO4 | FeCl3 |
A.①②③④ B.①②③ C.①③ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
氮氧化物与悬浮在大气中的海盐粒子相互反应:
4NO2(g)+2NaCl(s)  2NaNO3(s)+2NO(g)+Cl2(g)
2NaNO3(s)+2NO(g)+Cl2(g)
在恒温条件下,向2L恒容密闭容器中加入0.4molNO2和0.2molNaCl,10min反应达到平衡时n(NaNO3)=0.1mol。下列叙述中正确的是
A.10min内NO浓度变化表示的速率v(NO)=0.01 mol·L-1·min-1
B.若保持其他条件不变,在恒压下进行该反应,则平衡时NO2的转化率大于50%
C.若升高温度,平衡逆向移动,则该反应的△H >0
D.若起始时向容器中充入NO2(g) 0.2mol、NO(g) 0.1mol和Cl2(g) 0.1mol(固体物质足量),则反应将向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
N2O5是一种新型硝化剂,在一定温度下可发生下列反应:
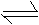 2N2O5(g) 4NO2(g)+O2(g) ΔH>0 ;T1温度下的部分实验数据为:
2N2O5(g) 4NO2(g)+O2(g) ΔH>0 ;T1温度下的部分实验数据为:
| t/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)/mol·L-1 | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法不正确的是( )
A.500 s内N2O5分解速率为2.96×10-3 mol·(L·s)-1
B.T1温度下的平衡常数为K1=125, 1000 s时转化率为50%
C.T1温度下的平衡常数为K1,T3温度下的平衡常数为K3,若K1>K3,则T1>T3
D.其他条件不变时,T2温度下反应到1000 s时测得N2O5(g)浓度为2.98 mol·L-1,则T1<T2
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系: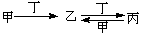 。下列有关物质的推断不·正确的是( )
。下列有关物质的推断不·正确的是( )
A.若甲为焦炭,则丁可能是O2
B.若甲为SO2,则丁可能是氨水
C.若甲为Fe,则丁可能是盐酸
D.若甲为NaOH 溶液,则丁可能是CO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com