
【题目】下列物质发生反应时,不因为反应的条件、反应物浓度或反应物的用量不同,而产物不同的是
A.钠与氧气 B.碳与氧气 C.硅和氯气 D.铁和硫酸
科目:高中化学 来源: 题型:
【题目】2013年初,雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。
汽车尾气净化的主要原理为:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。
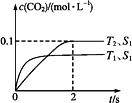
据此判断:
(1)该反应的ΔH____(填“>”或“<”)0。
(2)在T2温度下,0~2 s内的平均反应速率v(N2)=____。
(3)当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线。___________________
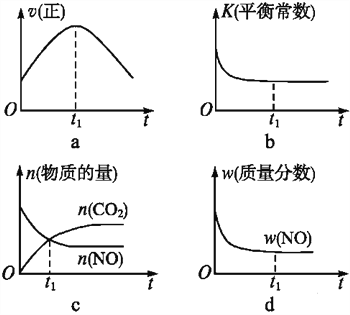
(4)若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是____(填代号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质](15分)
“摩尔盐”是分析化学中的重要试剂,化学式为(NH4)2Fe(SO4)2·6H2O。“摩尔盐”在一定条件下分解的方程式为:4[(NH4)2Fe(SO4)2·6H2O]![]() 2Fe2O3+3SO3+5SO2↑+N2↑+6NH3↑+31H2O。回答下列问题:
2Fe2O3+3SO3+5SO2↑+N2↑+6NH3↑+31H2O。回答下列问题:
(1)铁元素在元素周期表中的位置为 ,其价层电子排布图为 。
(2)组成“摩尔盐”的非金属元素中第一电离能最大的元素为 。“摩尔盐”的分解产物中属于非极性分子的化合物是____。
(3)NH3的沸点比N2O的沸点 (填“高”或“低”),其主要原因是 。
(4)K3[Fe(CN)6]常用于检验Fe2+,K3[Fe(CN)6]中除了离子键以外还存在的化学键为_______ ____,与CN—互为等电子体的单质的分子式为___ _。HCN分子中σ键和π键的个数之比为 。
(5)FeO晶胞结构如下图所示,FeO晶体中Fe2+配位数为__________,若该晶胞边长为acm,则该晶胞密度为__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2A(g)+3B(g)![]() 2C(g)+D(g)在四种不同条件下的反应速率分别为:
2C(g)+D(g)在四种不同条件下的反应速率分别为:
①![]() (A)=0.5 mol·L—l·min—l ②
(A)=0.5 mol·L—l·min—l ②![]() (B)=0.6 mol·L—l·min—l
(B)=0.6 mol·L—l·min—l
③![]() (C)=0.35 mol·L—l·min—l ④
(C)=0.35 mol·L—l·min—l ④![]() (D)=0.4 mol·L—l·min—l
(D)=0.4 mol·L—l·min—l
则该反应在不同条件下反应速率最快的是( )
A. ① B. ② C. ③ D. ④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g)![]() C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
C(g)+D(g)过程中的能量变化如图所示,回答下列问题.

(1)该反应是 反应(填“吸热”、“放热”).
(2)当反应达到平衡时,升高温度,A的转化率 (填“增大”、“减小”、“不变”),原因是
(3)反应体系中加入催化剂对反应热是否有影响? (填“有”、“无”),原因是 .
(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1 ,E2 (填“增大”、“减小”、“不变”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)CO是合成尿素、甲酸的原料。
(1)在100 kPa和T K下,由稳定单质生成1 mol化合物的焓变称为该物质在T K时的标准摩尔生成焓,用符号ΔHm0表示。已知石墨和CO的标准燃烧热分别为393.5 kJmol1和283.0 kJmol1,则CO(g)的ΔHm0= 。
(2)合成尿素的反应:2NH3(g) + CO(g) == CO(NH2)2(g) + H2(g) ΔH =81.0 kJmol1。
①T ℃时,在体积为2 L的恒容密闭容器中,将2 molNH3和1 mol CO混合发生反应,5 min时,NH3的转化率为80%。则0~5 min内的平均反应速率为v(CO)= 。
②已知:
温度/K | 398 | 498 | … |
平衡常数(K) | 126.5 | K1 | … |
则:K1 126.5(填“>”或“<”);其判断理由是 。
③若保持恒温恒容条件,将物质的量之和为3 mol的NH3和CO以不同的氨碳比进行反应,结果如图所示:

若图中c表示平衡体系中尿素的体积分数,则a表示 的转化率。
当![]() = 时,尿素含量最大;此时,对于该反应既能增大正反应速率又能使平衡正向移动的措施是 (写一种)。
= 时,尿素含量最大;此时,对于该反应既能增大正反应速率又能使平衡正向移动的措施是 (写一种)。
(3)通过人工光合作用可将CO转化成HCOOH。
①已知常温下,浓度均为0.1 molL1的HCOOH和HCOONa混合溶液pH =3.7,则HCOOH的电离常数Ka的值为 (已知lg2=0.3)。
②用电化学可消除HCOOH对水质造成的污染,其原理是电解CoSO4、稀硫酸和HCOOH混合溶液,用电解产生的Co3+将HCOOH氧化成CO2。Co3+氧化HCOOH的离子方程式为 ;忽略体积变化,电解前后Co2+的浓度将 (填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】(15分)
第四周期的过渡元素在工业、农业、科学技术以及人类生活等方面有重要作用。请回答:
(1)科学研究表明用TiO2作光催化剂可将废水中CN转化为OCN、并最终氧化为N2、CO2。OCN—中三种元素的第一电离能由大到小的顺序为 。与OCN互为等电子体的一种分子为 (填化学式)。
(2)Ti(BH4)2是一种储氢材料。写出基态Ti2+的电子排布式 ,BH4—中B原子的杂化轨道类型是 。
(3)[Cr(H2O)4Cl2]Cl·2H2O中Cr的配位数为__________;
已知CrO5中Cr为+6价,则CrO5的结构式为____________。
(4)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,该分子呈正四面体构型。试推测Ni(CO)4的晶体类型为________,Ni(CO)4易溶于下列_______(填选项字母)中。
A.水 B.四氯化碳 C.苯 D.硫酸镍溶液
(5)FeO、NiO晶体中r(Ni2+)和r(Fe2+)分别为69 pm和78 pm,则熔点NiO______FeO(填“>”或“<”),原因为_____________________。
(6)硒化锌(SnSe)是一种重要的半导体材料,其晶胞结构如图所示,则该晶胞中硒原子的配位数 为 ;若该晶胞密度为ρ g·cm3,硒化锌的摩尔质量为M g/mol。NA代表阿伏加德罗常数,则晶胞参数a为 pm。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com