
| A.将等体积pH=4的盐酸和醋酸稀释到pH=5的溶液,醋酸所加的水量多 |
| B.氯化钠溶液呈中性,醋酸钠溶液呈碱性 |
| C.相同pH的盐酸和醋酸分别跟锌反应时,产生氢气的起始速率相等 |
| D.等体积、相同pH的盐酸和醋酸溶液中分别加入相应的钠盐固体,醋酸pH变大 |


科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 实验编号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合溶液 的pH |
| a | 0.1 | 0.1 | pH=9 |
| b | c | 0.2 | pH=7 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.m>n | B.m=n | C.m<n | D.不能确定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 >HSO3->
>HSO3->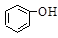 水杨酸(
水杨酸( )与亚硫酸钠溶液反应,可能发生反应的离子方程式书写正确的是
)与亚硫酸钠溶液反应,可能发生反应的离子方程式书写正确的是A. + SO32―→ + SO32―→ + HSO3― + HSO3― |
B. + SO32―→ + SO32―→ +HSO3― +HSO3― |
C.2 + SO32―→2 + SO32―→2 +SO2↑+H2O +SO2↑+H2O |
D. +2SO32―→ +2SO32―→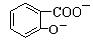 +2HSO3― +2HSO3― |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.曲线I为醋酸稀释时pH值变化曲线 |
| B.a点时,若都加入相同大小的锌粒,此时盐酸反应的速率大 |
| C.a点时,若都加入足量的锌粒,最终与醋酸反应产生的氢气多 |
| D.b点溶液中水的电离程度比c点溶液中水的电离程度小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 CH3COO-+H+,要使电离平衡右移且c(CH3COO—)增大,应采取的措施是 ( )
CH3COO-+H+,要使电离平衡右移且c(CH3COO—)增大,应采取的措施是 ( ) | A.加入盐酸 | B.加入NaOH(s) | C.加蒸馏水 | D.升高温度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com