
| A. | 经实验测定等物质的量的盐酸、醋酸分别与足量NaOH溶液反应放出的热量相等 | |
| B. | 中和热测定实验中可以用环形铁丝搅拌棒代替环形玻璃搅拌棒 | |
| C. | 用碱式滴定管量取0.10 mol•L-1的Na2CO3溶液22.10 mL | |
| D. | 用玻璃棒蘸取溶液滴到湿润的广范pH试纸上,测其pH=3.6 |
分析 A.醋酸为弱电解质,电离吸热;
B.环形铁丝搅拌棒导热性强;
C.碱式滴定管量取碱性溶液,且能准确到0.01mL;
D.广范pH试纸,只能测定整数.
解答 解:A.醋酸为弱电解质,电离吸热,则等物质的量的盐酸、醋酸分别与足量NaOH溶液反应放出的热量不等,醋酸与碱反应放出的热量少,故A错误;
B.环形铁丝搅拌棒导热性强,不能代替环形玻璃搅拌棒,否则测定中和热偏小,故B错误;
C.碱式滴定管量取碱性溶液,且能准确到0.01mL,则用碱式滴定管量取0.10 mol•L-1的Na2CO3溶液22.10 mL,故C正确;
D.广范pH试纸,只能测定整数,不能得到pH=3.6,故D错误;
故选C.
点评 本题考查化学实验方案的设计,为高频考点,涉及中和热及测定、仪器使用、pH的测定等,把握反应原理及实验基本操作为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | CO(g)的燃烧热是283.0 kJ•mol-1,则2CO2(g)=2CO(g)+O2(g)反应的△H=+2×283.0 kJ•mol-1 | |
| B. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ•mol-1 | |
| C. | 1 mol甲烷燃烧生成液态水和二氧化碳所放出的热量是甲烷燃烧热 | |
| D. | 需要加热才能发生的反应不一定是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在潮湿疏松透气的土壤中 | B. | 在干燥致密不透气的土壤中 | ||
| C. | 在含铁元素较多的酸性土壤中 | D. | 在含碳粒较多,潮湿透气的土壤中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
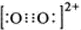 ;1mol O22+中含有的π键数目为2NA.
;1mol O22+中含有的π键数目为2NA.| 代号 | 结构简式 | 水中溶解度/g(25℃) | 熔点/℃ | 沸点/℃ |
| X | 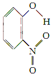 | 0.2 | 45 | 100 |
| Y | 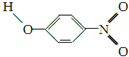 | 1.7 | 114 | 295 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜片加入稀盐酸中:Cu+2H+=Cu2++H2↑ | |
| B. | 盐酸滴加在石灰石上:CO32-+2H+=H2O+CO2↑ | |
| C. | 氢氧化钡溶液与稀硫酸混合:Ba2++SO42-+H++OH-=BaSO4↓+H2O | |
| D. | 硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-+Cu2++2 OH-=BaSO4↓+Cu(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | Pb2+ | Ca2+ | Fe3+ | Mn2+ | Cl- |
| 处理前浓度(mg/L) | 0.100 | 29.8 | 0.120 | 0.087 | 51.9 |
| 处理后浓度(mg/L) | 0.004 | 22.6 | 0.040 | 0.053 | 49.8 |
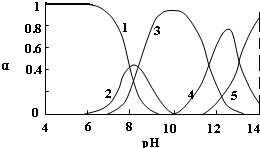
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 单质铁与盐酸的反应 Fe+2 H+=Fe2++H2↑ | |
| B. | 氨水跟硫酸发生酸碱中和反应 OH-+H+=H2O | |
| C. | 铜片插入硝酸银溶液中Cu+Ag+=Cu2++Ag | |
| D. | 碳酸钙加入醋酸溶液中 CaCO3+2CH3COOH=CO2↑+2CH3COO-+H2O+Ca2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com