
| A. | O2 | B. | SO2 | C. | Cl2 | D. | NH3 |
分析 同温同压下,气体摩尔体积相等,根据ρ=$\frac{M}{{V}_{m}}$判断气体密度大小.
解答 解:同温同压下,气体摩尔体积相等,O2的摩尔质量是32g/mol,氯气的摩尔质量是71g/mol,SO2的摩尔质量是64g/mol,NH3的摩尔质量是17g/mol,根据ρ=$\frac{M}{{V}_{m}}$知,气体密度大小与其摩尔质量成正比,所以摩尔质量越大,其密度越大,所以密度最大的是氯气,
故选C.
点评 本题考查了阿伏伽德罗定律及推论,为高频考点,侧重于学生的分析、计算能力的考查,明确密度与气体摩尔质量的关系是解本题关键,根据条件结合ρ=$\frac{M}{{V}_{m}}$来分析解答即可,难度不大.


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢铵溶液与足量的氢氧化钠溶液反应:NH4++OH-=NH3•H2O | |
| B. | 钠与水反应:Na+2H2O=Na++2OH-+H2↑ | |
| C. | 铜和稀硝酸反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O | |
| D. | 氯化铝溶液显酸性:Al3++3H2O?Al(OH)3↓+3H + |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤⑦ | B. | ①④⑥⑦ | C. | ①②③④⑥ | D. | ①③④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
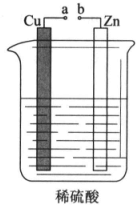 课外小组的同学对如图所示的实验装置进行了研究.
课外小组的同学对如图所示的实验装置进行了研究.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所含共用电子对数目为($\frac{m}{7}$+1)NA | B. | 所含碳氢键数目为$\frac{m{N}_{A}}{7}$ | ||
| C. | 燃烧时消耗的O2一定是33.6m/14 L | D. | 所含原子总数为$\frac{m{N}_{A}}{14}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com