
| A. | ①② | B. | ①②③ | C. | ①②③④ | D. | ①③ |
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| T | M层的电子数是原子核外电子层数的2倍 |
| X | 原子最外层电子数是次外层的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正化合价是+7价 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
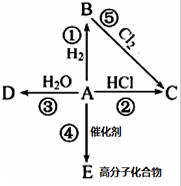 烃A(乙烯)是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A在一定条件下可发生如图所示的转化,请回答下列问题:
烃A(乙烯)是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A在一定条件下可发生如图所示的转化,请回答下列问题: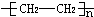 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氢气是清洁能源,也是重要的化工原料.
氢气是清洁能源,也是重要的化工原料.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用玻璃棒搅拌漏斗中的液体可以加快过滤的速度 | |
| B. | 用澄清的石灰水可鉴别CO2和SO2 | |
| C. | 某元素从化合态变为游离态时,该元素可能被氧化也可能被还原 | |
| D. | 金属阳离子被还原不一定得到金属单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com