
氯化亚铁溶液中滴加硫氰化钾溶液,再滴加双氧水,立即出现血红色,后红色又褪去呈黄色并伴有气泡产生,针对该实验现象,某实验小组的同学进行了探究
一、现象分析
假设A:气泡是H2O2分解产生的O2
假设B:气泡是KSCN被氧化为N2、SO2、CO2等
假设C:红色褪去的原因是KSCN被氧化成了其它物质
二、实验探究
探究1
| 实验操作 | 实验现象 | 结论 |
| ①1mL 0.1mol/L的FeCl2溶液中加2滴KSCN溶液 | 溶液不变红 | Fe2+遇SCN-不变红 |
| ②向①的溶液中加3%的H2O21滴并振荡 | 立即出现血红色 振荡后不褪色 | 加入H2O2后溶液中 出现了 (离子符号) |
| ③向②的溶液中继续加H2O2溶液 | 溶液中出现大量气泡 血红色褪去 | |
| ④用带火星的木条检验③中的气体 | 木条复燃 | 则假设 成立 |
| 实验操作 | 实验现象 | 结论 |
| ①取2ml KSCN溶液向其中加入几滴BaCl2溶液和稀盐酸 | 无明显现象 | |
| ②向①所得的溶液中滴加3%的H2O2 | 溶液中出现白色沉淀并有少量气泡 | 白色沉淀为BaSO4 |
| ③将6%的H2O2溶液加入KSCN固体中,生成的气体依次通过品红溶液,酸性KMnO4溶液和澄清的石灰水 | | KSCN被H2O2氧化生成了SO2和CO2气体 |
(离子方程式3分,其余每空2分,共15分)
探究1实验操作 实验现象 结论 ①1mL 0.1mol/L的FeCl2溶液中加2滴KSCN溶液 溶液不变红 Fe2+遇SCN-不变红 ②向①的溶液中加3%的H2O21滴并振荡 立即出现血红色
振荡后不褪色加入H2O2后溶液中
出现 Fe3+ (离子符号)③向②的溶液中继续加H2O2溶液 溶液中出现大量气泡
血红色褪去 ④用带火星的木条检验③中的气体 木条复燃 假设 A 成立
三、问题与讨论
(1)生成的FeCl3对H2O2的分解起催化作用
(2) Fe2+>SCN-
(3) 吸收SO2气体 , 酸性KMnO4溶液不褪色,澄清的石灰水变浑浊
(4)2SCN-+10 H2O2=N2↑+2CO2↑+SO2↑+SO4-+10H2O
解析试题分析:本题将探究的方案和设计已经给出,着重考查分析问题和解决问题的能力。通过对实验现象和结论的分析可以回答相关的问题,应用结论和氧化还原反应理论可以写出反应方程式。
考点:以探究为基础,考查学生分析问题、解决问题的能力和氧化还原反应、元素及化合物、物质检验等相关知识。


科目:高中化学 来源: 题型:实验题
如图实验装置用于验证某些物质的性质.在试管A中装入足量的固体NaHCO3.试回答下列问题: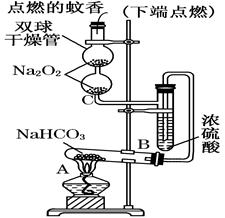
(1)在A试管内发生反应的化学方程式是_______________________________________________;
(2)B装置的作用是__________________________________________________;
(3)在双球干燥管内发生反应的化学方程式为___________________________________________;
(4)双球干燥管内观察到的实验现象是___ _____, 上述实验现象说明_________________ _;
(5)若将干燥管内的Na2O2换成Na2O,则双球干燥管内观察到的实验现象是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(16分)铁触媒(铁的某氧化物)是工业合成氨的催化剂。某同学设计了以下两种方案研究铁触媒的组成。
方案一:用下列流程测定铁触媒的含铁量,确定其组成。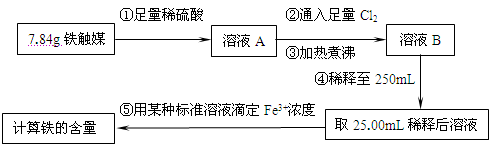
(1)步骤④后面需用 (填仪器名称)取25.00mL稀释后溶液。
(2)因为通入Cl2不足量,“溶液B”中还含有 会影响测定结果。
(3)因为通入Cl2过量且加热煮沸不充分,“溶液B”中可能含有Cl2。请设计实验方案检验Cl2,完成下列实验报告。
限选试剂:0.1mol·L-1酸性KMnO4溶液、紫色石蕊试液、品红稀溶液、淀粉-KI溶液、0.1moL·L-1KSCN溶液
| 实验操作 | 实验现象与结论 |
| | |
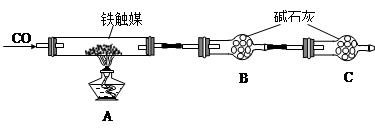
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
为测定某补血剂样品〔主要成分是硫酸亚铁晶体(FeSO4·7H2O)〕中铁元素的含量,某化学兴趣小组设计了两套实验方案:
方案一:用酸性KMnO4溶液滴定测定铁元素的含量
⑴写出滴定反应的离子方程式 。
(2)下列滴定方式中,最合理的是 (夹持仪器略去)(填字母序号〕
(3)实验前,首先要准确配制一定物质的量浓度的酸性KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需_ (填仪器名称)。
(4)若某同学取5片补血剂样品配成100 mL溶液,取20. 00 mL试样,用浓度为c1mol·L-1的KMnO4溶液滴定,耗去V1 mL,则每片补血剂含铁元素的质量_ g(用代数式表示)。
方案二:将FeSO4转化为Fe2O3,测定质量变化。操作流程如下: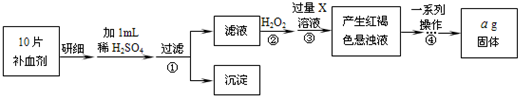
(5)步骤②中用H2O2的目的是_ _。
(6)步骤④中一系列操作依次是:过滤、洗涤、_ 、冷却、称量。
(7)假设实验无损耗,则每片补血剂含铁元素的质量为_ g(用含a的代数式表示)。
(8)若某同学设计以原电池的形式实现Fe2+至Fe3+的转化,正极通人O2,电解质溶液为稀硫酸,请写出正极的电极反应式 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校化学实验小组通过实验探究某红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
查阅资料:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4。
设计探究实验:取少量粉末放入足量稀硫酸中,在所得溶液中滴加KSCN试剂。
(1)若只有Fe2O3,则实验现象是_____________。
(2)若固体粉末完全溶解无固体存在,滴加KSCN试剂时溶液不变红色,则此过程中的离子反应为:
____________________________。
(3)经实验分析,确定红色粉末为Cu2O和Fe2O3的混合物。实验小组欲测定Cu2O的质量分数。已知Cu2O在空气中加热生成CuO。
测定流程: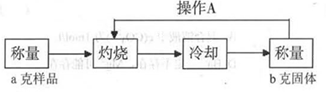
实验中操作A的名称为_____________。
灼烧过程中,所需仪器有:酒精灯、玻璃棒、_____________等(夹持仪器除外)。
(4)写出混合物中Cu2O的质量分数的表达式_____________。
实验小组欲利用红色粉末制取较纯净的胆矾(CuSO4?5H2O)。经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下: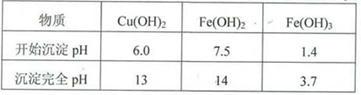
实验室有下列试剂可供选择:
| A.氯水 | B.H2O2 | C.NaOH | D.Cu2(OH)2CO3 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
为探究Fe(NO3)2等硝酸盐热分解产物和产物的性质,某化学小组开展如下探究:
【查阅资料】2KNO3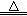 2KNO2+O2↑ Fe(NO3)2
2KNO2+O2↑ Fe(NO3)2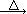 FexOy+NO2↑+O2↑
FexOy+NO2↑+O2↑
实验一:探究Fe(NO3)2热分解固体产物中铁元素的价态。该小组甲同学将分解后的固体产物溶于足量的稀H2SO4得到相应两份溶液,进行以下探究实验。
(1)【提纯猜想】
猜想一:铁元素只显+2价;
猜想二:铁元素 ;
猜想三:铁元素既有+2价又有+3价。
【实验操作】①向一份溶液中滴入KSCN溶液;向另一份溶液中滴入酸性KMnO4稀溶液。
(2)【实验现象】实验① ;实验② 。
(3)【实验结论】猜想二成立,则Fe(NO3)2分解的化学方程式是 。
实验二:
(4)探究Fe(NO3)2热分解气体产物的性质。小组乙同学进行料如下实验,请完成实验空缺部分内容。限选试剂和用品:浓H2SO4溶液、4mol/LNaOH溶液、0.1mol/LBaCl2溶液、带火星的木条、0.1mol/L酸性KMnO4溶液、蒸馏水。
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量Fe(NO3)2固体于试管中,加热分解。 | ,说明分解产生的气体中含有NO2。 |
| 步骤2:将产生的气体依次通过盛有足量 、浓硫酸的洗气瓶, 在最后一个出口检验。 | ,说明分解产生的气体中含O2。 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应)。有研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究。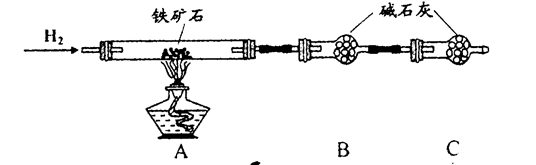
实验一:铁矿石中含氧量的测定
a.按上图组装仪器(夹持仪器均省略),检查装置的气密性;
b.将5.0g铁矿石放入硬质玻璃管中;
c.从左端导气管口处不断地缓缓通入H2,待C装置出口处对H2验纯后,点燃A处酒精灯;
d.充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却。
(1)装置C的作用为_______________________________________________________。
(2)测得反应后装置B增重1.35g,则铁矿石中氧的质量分数为______________________。
实验二:铁矿石中含铁量的测定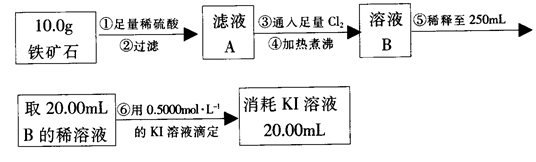
(3)步骤④中煮沸的目的是_____________________________________________。
(4)步骤⑤中用到的玻璃仪器有烧杯、胶头滴管、_________________________。
(5)下列有关步骤⑥的操作中说法不正确的是_______________________________。
a.滴定管用蒸馏水洗涤后再用待装液润洗
b.锥形瓶不需要用待测液润洗
c.因为碘水为黄色,所以滴定过程中不需加指示剂
d.滴定过程中可利用淀粉溶液作为指示剂
(6)铁矿石中铁的质量分数为______________________________________________。
实验结论:推算铁的氧化物的组成
(7)由实验一、二得出该铁矿石中铁的氧化物的化学式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
现有等物质的量的铜和银的混合物17.2 g,与50.0 mL的浓硝酸恰好完全反应,产生气体4.48 L(标准状况),则下列说法正确的是
| A.产生的气体是0.2 mol NO2 |
| B.硝酸的物质的量浓度为12 mol·L-1 |
| C.反应中被还原和未被还原的硝酸物质的量之比为3∶2 |
| D.要使产生的气体恰好完全被水吸收需要通入氧气0.075 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
NO因污染空气而“臭名昭著”,而奇妙的作用也使其成为“明星分子”。如可用于制HNO3、肥料、炸药、促进血管扩张、促进免疫功能、增强记忆等。下列各组物质中,不能生成NO的是( )
| A.Cu + HNO3(稀) | B.N2 + O2 | C.NH4Cl + O2 | D.NO2 + H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com