
T1、T2两种温度下BaSO4在水中的沉淀溶解平衡曲线如图所示,请回答下列问题:
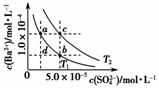
(1)T1________T2(填“>”、“<”或“=”),T2时Ksp(BaSO4)=________。
(2)根据T1温度时BaSO4的沉淀溶解平衡曲线,判断下列说法正确的是________(填序号)。
A.加入Na2SO4可由a点变为b点
B.在T1曲线上方区域(不含曲线)的任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能由d点变为T1曲线上a、b之间的某一点(不含a、b)
D.升温可由b点变为d点
(3)沉淀的生成、溶解和转化在无机物制备和提纯及科研等领域有着广泛应用。已知25 ℃时,Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=1×10-9。
①医学上进行消化系统的X射线透视时,常使用BaSO4作内服造影剂。胃酸酸性很强(pH约为1),但服用大量BaSO4仍然是安全的,BaSO4不溶于酸的原因是___________________________________________________________
__________________________________________________________________
(用沉淀溶解平衡原理解释)。万一误服了少量BaCl2,应尽快用大量0.5 mol
·L-1 Na2SO4溶液洗胃,如果忽略洗胃过程中Na2SO4溶液浓度的变化,残留在胃液中的Ba2+浓度仅为________ mol·L-1。
②长期使用的锅炉需要定期除水垢,否则会降低燃料的利用率。水垢中含有CaSO4,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去。CaSO4转化为CaCO3的离子方程式为_____________________。
解析 (1)温度越高BaSO4的溶解度越大,T1温度下的离子积较小,所以T1<T2。T2时的溶度积可利用c点的数据进行计算求得。(2)由于存在溶解平衡,加入Na2SO4,SO 浓度增大,BaSO4的沉淀溶解平衡逆向移动,Ba2+的浓度降低,A选项正确;T1曲线上方区域的离子积大于溶度积,所以会析出沉淀,B选项正确;蒸发溶剂,不饱和溶液中Ba2+和SO
浓度增大,BaSO4的沉淀溶解平衡逆向移动,Ba2+的浓度降低,A选项正确;T1曲线上方区域的离子积大于溶度积,所以会析出沉淀,B选项正确;蒸发溶剂,不饱和溶液中Ba2+和SO 的浓度都变大,可能由d点变为T1曲线上a、b之间的某一点,C选项正确;升高温度,c(SO
的浓度都变大,可能由d点变为T1曲线上a、b之间的某一点,C选项正确;升高温度,c(SO )、c(Ba2+)会变大,D选项错误。(3)①由沉淀溶解平衡BaSO4(s)===Ba2+(aq)+SO
)、c(Ba2+)会变大,D选项错误。(3)①由沉淀溶解平衡BaSO4(s)===Ba2+(aq)+SO (aq)可知,H+不能减小Ba2+或SO
(aq)可知,H+不能减小Ba2+或SO 的浓度,平衡不能向溶解方向移动。由c(SO
的浓度,平衡不能向溶解方向移动。由c(SO )=0.5 mol·L-1和c(Ba2+)·c(SO
)=0.5 mol·L-1和c(Ba2+)·c(SO )=1×10-10可知c(Ba2+)=2×10-10 mol·L-1。②CaSO4转化为CaCO3的离子方程式为CaSO4(s)+CO
)=1×10-10可知c(Ba2+)=2×10-10 mol·L-1。②CaSO4转化为CaCO3的离子方程式为CaSO4(s)+CO (aq)===CaCO3(s)+SO
(aq)===CaCO3(s)+SO (aq)。
(aq)。
答案 (1)< 5.0×10-9 (2)ABC (3)①对于沉淀溶解平衡BaSO4(s)Ba2+(aq)+SO (aq),H+不能减小Ba2+或SO
(aq),H+不能减小Ba2+或SO 的浓度,平衡不能向溶解方向移动 2×10-10 ②CaSO4(s)+CO
的浓度,平衡不能向溶解方向移动 2×10-10 ②CaSO4(s)+CO (aq)===CaCO3(s)+SO
(aq)===CaCO3(s)+SO (aq)
(aq)


科目:高中化学 来源: 题型:
下列关于有机物的说法中,不正确的是 ( )。
A.2甲基丁烷和正戊烷互为同分异构体
B.氯乙烯分子内所有原子均在同一平面
C.用溴水既可以鉴别甲烷和乙烯,也可以除去甲烷中的乙烯
D.苯不能使KMnO4溶液褪色,因此苯不能发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
人们对苯及芳香烃的认识有一个不断深化的过程,回答下列问题。
(1)由于苯的含碳量与乙炔相同,人们认为它是一种不饱和烃,写出分子式为C6H6的一种含两个三键且无支链的链烃的结构简式____________________________________。
(2)已知分子式为C6H6的有机物有多种,其中的两种为:
(Ⅰ)  (Ⅱ)
(Ⅱ)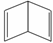
①这两种结构的区别表现在以下两方面:
定性方面(即化学性质方面):(Ⅱ)能__________(填字母),而(Ⅰ)不能。
a.被高锰酸钾酸性溶液氧化
b.与溴水发生加成反应
c.与溴发生取代反应
d.与氢气发生加成反应
定量方面(即消耗反应物的量的方面):1 mol C6H6与H2加成时:(Ⅰ)需要H2______mol,而(Ⅱ)需要H2______mol。
②
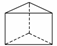
今发现C6H6还可能有另一种如右图所示的立体结构,该结构的二氯代物有____种。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学知识的应用,能用沉淀溶解平衡原理来解释的是 ( )。
①热纯碱溶液洗涤油污的能力强;②误将钡盐[BaCl2、Ba(NO3)2]当作食盐食用时,常用0.5%的Na2SO4溶液解毒;③溶洞、珊瑚的形成;④泡沫灭火器灭火的原理
A.②③ B.①②③
C.③④ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室测定水体中氯离子的含量时常使用AgNO3溶液滴定法,已知在25 ℃时几种银盐的Ksp:
| 难溶盐 | AgCl | AgBr | AgI | Ag2CrO4 | Ag2CO3 |
| Ksp | 1.8×10-10 | 5.4×10-13 | 8.3×10-17 | 1.9×10-12 | 8.1×10-12 |
| 颜色 | 白色 | 淡黄色 | 黄色 | 砖红色 | 白色 |
可用作滴定Cl-指示剂的是 ( )。
A.K2CrO4 B.Na2CO3
C.NaBr D.NaI
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨时既要使氨的产率增大,又要使反应速率加快,可采取的办法是
( )。
①减压 ②加压 ③升温 ④降温 ⑤及时从平衡混合气中分离出NH3
⑥补充N2或H2 ⑦加催化剂 ⑧减小N2或H2的量
A.③④⑤⑦ B.①②⑤⑥
C.②⑥ D.②③⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
四川有丰富的天然气资源,以天然气为原料合成尿素的主要步骤如下图所示(图中某些转化步骤及生成物未列出):

请填写下列空白:
(1)已知0.5 mol甲烷与0.5 mol水蒸气在t ℃、p kPa时,完全反应生成一氧
化碳和氢气(合成气),吸收了a kJ热量,该反应的热化学方程式是:
________________________________________________________________。
(2)在合成氨的实际生产过程中,常采取的措施之一是:将生成的氨从混合气
体中及时分离出来,并将分离出氨后的氮气和氢气循环利用,同时补充氮气
和氢气。请运用化学反应速率和化学平衡的观点说明采取该措施的理由:
________________________________________________________________。
(3)当甲烷合成氨气的转化率为75%时,以5.60×107 L甲烷为原料能够合成
________L氨气。(假设体积均在标准状况下测定)
(4)已知尿素的结构简式为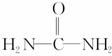 ,请写出两种含有碳氧双键的尿素
,请写出两种含有碳氧双键的尿素
的同分异构体的结构简式:
①_______________________________________________________________;
②_______________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com