
(10分)K2EO4(E代表某种元素)在工业上有重要的应用,以下是制备该物质的工艺流程图:
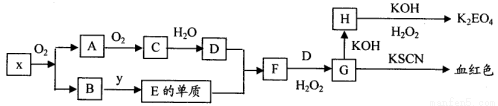
已知:A和C是由同一主族元素组成的化合物,x是工业上制D的重要原料。
请回答以下问题:
(1)x的化学式是 ,H的化学式是 。
(2)写出F→G的离子反应方程式 。
(3)要工业上实现B→E的转化,y的化学式可能是 。
(4)1molH转化为K2EO4时需H2O2的物质的量是 。
(1)FeS2 (2分) Fe(OH) 3(2分)
(2)2Fe2++2H++H2O2=2Fe3++2H2O(2分)(3)CO (2分)(4)1.5mol(2分)
【解析】
试题分析:根据物质的性质及相互转化关系可知X是FeS2;A是SO2;B是Fe2O3;C是SO3;D是H2SO4;Y是CO;E是Fe;F的FeSO4;G是Fe2(SO4)3;H是Fe(OH)3;K2EO4是K2FeO4。(1)x的化学式是FeS2;H的化学式是Fe(OH) 3;(2)H2O2=有强氧化性,能够把FeSO4氧化为Fe2(SO4)3。根据电子守恒和元素守恒可得:F→G的离子反应方程式是2Fe2++2H++H2O2=2Fe3++2H2O;(3)在工业上实现铁的化合物变为Fe,即冶炼Fe。则要实现B→E的转化,y的化学式可能是CO;(4)在Fe(OH)3中Fe的化合价是+3价,由于在K2FeO4中Fe的化合价是+6价,根据电子转移的数目相等可知:1molH转化为K2EO4时需H2O2的物质的量是1.5mol。
考点:考查物质的性质及相互转化、物质的化学式的书写、氧化还原反应的离子方程式的书写及相应的计算的知识。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014-2015学年湖南省益阳市高二上学期期中化学(文)试卷(解析版) 题型:选择题
下列实验操作均要用玻璃棒,其中玻璃棒的作用相同的是
①过滤 ②蒸发 ③溶解 ④向容量瓶转移溶液
A.①和② B.①和③ C.③和④ D.①和④
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省宁德市五校高二上学期期中化学试卷(解析版) 题型:选择题
下图小试管内为红墨水,具支试管内盛有pH=4久置的雨水和生铁片。实验观察到:开始时导管内液面下降,一段时间后导管内液面回升,略高于小试管内液面。下列说法正确的是
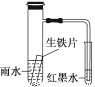
A.生铁片中的碳是原电池的负极,发生还原反应
B.雨水酸性较强,生铁片始终发生析氢腐蚀
C.墨水回升时,碳电极反应式为O2+2H2O+4e-===4OH-
D.具支试管中溶液酸性增强
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省宁德市五校高二上学期期中化学试卷(解析版) 题型:选择题
在一定条件下,对于反应2A(g)+B(g)  2C(g),下列说法中正确的是
2C(g),下列说法中正确的是
A.此反应的平衡常数K=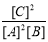
B.改变条件该反应的平衡常数K一定不变
C.改变压强并加入催化剂,平衡常数会随之变化
D.平衡时增大A和B的浓度,平衡常数会减小
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三上学期期中考试化学试卷(解析版) 题型:选择题
下列有关电解质溶液中微粒的物质的量浓度关系正确的是
A.pH=3的一元酸和pH=11的一元强碱等体积混合后的溶液中:c(OH-)=c(H+)
B.在0.1 mol·L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3)
C.已知叠氮酸(HN3)与醋酸酸性相近,则在NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(OH?)>c(N3?)>c(H+)
D.0.2 mol·L-1NaHCO3溶液中加入等体积0.1 mol·L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三上学期期中考试化学试卷(解析版) 题型:选择题
将1 L 1.00 mol/L 的Na2CO3溶液逐滴加入到1 L 1.25 mol/L的盐酸中;再做相反操作:将1 L 1.25 mol/L的盐酸逐滴加入1 L 1.00 mol/L 的Na2CO3溶液中,两次操作产生的气体体积之比是(同温同压下)
A.2∶5 B.5∶2 C.1∶1 D.2∶1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省焦作市高三上学期期中化学试卷(解析版) 题型:选择题
已知酸性高锰酸钾溶液可以将FeSO4氧化,方程
2KMnO4+10FeSO4+8H2SO4→K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,
现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的物质的量的变化关系如图所示。
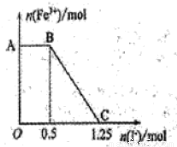
则下列有关说法错误的是
A.图中AB段主要是高锰酸钾和碘化钾溶液反应
B.图中BC段发生的反应为2Fe3++2I-= 2Fe2++ I2。
C.根据OC段的数据可知开始加入的高锰酸钾的物质的量为0.25 mol
D.根据OC段的数据可知开始加入的硫酸亚铁的物质的量为1 mol
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省等四校高三上学期期中联考化学试卷(解析版) 题型:选择题
在体积固定的密闭容器中进行可逆反应2NO2 2NO+O2,下列能作为反应达到平衡状态标志的是
2NO+O2,下列能作为反应达到平衡状态标志的是
①单位时间内生成nmol O2的同时生成2n mol NO2
②单位时间内生成n mol O2 的同时生成2n mol NO
③用NO2 、NO、O2表示的反应速率之比为2∶2∶1
④混合气体的颜色不再改变
⑤混合气体的密度不再改变
⑥混合气体的压强不再改变
⑦混合气体的平均相对分子质量不再改变
A.①④⑥⑦ B.②③⑤⑦ C.①③④⑤ D.全部
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com