
| A. | 杂化轨道不可以参与π键的形成 | B. | 多原子单质分子都是非极性分子 | ||
| C. | 共价键都有方向性 | D. | 共价化合物中可以含有离子键 |
分析 A.杂化轨道形成σ键;
B.分子中正负电荷中心不重合,这样的分子为极性分子;分子中正负电荷的重心重合,则为非极性分子;
C.共价键形成与电子云重叠方向及数目有关;
D.只含共价键的化合物是共价化合物.
解答 解:A.杂化轨道只用于形成σ键或用于容纳未参与成键的孤对电子,没有杂化的P轨道形成π键,故A正确;
B.多原子单质分子不都是非极性分子,如O3分子的结构如图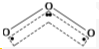 ,在臭氧O3中,中心的氧原子以sp2杂化,与两旁的配位氧原子键合生成两个σ键,使O3分子呈V形,O3形成的是三中心四电子大π键,空间构型不对称.正负电荷重心不重合,所以是极性分子,故B错误;
,在臭氧O3中,中心的氧原子以sp2杂化,与两旁的配位氧原子键合生成两个σ键,使O3分子呈V形,O3形成的是三中心四电子大π键,空间构型不对称.正负电荷重心不重合,所以是极性分子,故B错误;
C.共价键形成与电子云重叠方向及数目有关,则共价键一般有方向性和饱和性,但s-sδ键没有方向性,故C错误;
D.只含共价键的化合物是共价化合物,所以共价化合物中不可能含有离子键,故D错误;
故选A.
点评 本题考查了化学键的主要类型、分子的极性,注意s电子为球形,s-sδ键没有方向性,题目难度中等.


科目:高中化学 来源: 题型:填空题
| 化学键 | C-H | C=C | C-C | H-H |
| 键能/(KJ•mol-1) | 414.4 | 615.2 | 347.4 | 435.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F六种物质的转化关系如图(反应条件和部分产物未标出).
A、B、C、D、E、F六种物质的转化关系如图(反应条件和部分产物未标出). ,反应④的
,反应④的查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q2=Q1 | B. | Q2<Q1 | C. | Q2>Q1 | D. | Q2≥Q1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,它的电子排布共有3个能级,5个轨道,核外电子有6种运动状态,价电子轨道表示式
,它的电子排布共有3个能级,5个轨道,核外电子有6种运动状态,价电子轨道表示式
 ,原子中能量最高的电子,其电子云在空间有x,y,z3个方向,原子轨道呈现纺锤形,它的最简单氢化物中键角是109°28′,其中心原子杂化类型为sp3,分子中含sp3-s(填成键的原子轨道名称)σ键
,原子中能量最高的电子,其电子云在空间有x,y,z3个方向,原子轨道呈现纺锤形,它的最简单氢化物中键角是109°28′,其中心原子杂化类型为sp3,分子中含sp3-s(填成键的原子轨道名称)σ键查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对已达到化学平衡的反应:2SO2(g)+O2(g)═2SO3(g)△H=-akJ/mol,增大压强,a值增大 | |
| B. | 凡是氧化还原反应,都是放热反应 | |
| C. | KW随温度、浓度的改变而改变 | |
| D. | 弱电解质的电离程度,与温度、浓度均有关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com