
| A. | 17g NH3所含的电子数是17NA | |
| B. | 32 g O3中含有氧原子的个数为2NA | |
| C. | 5.6gFe与足量盐酸完全反应,Fe失去的电子数为0.3NA | |
| D. | 标准状况下,11.2 LH2O中含有O-H键的数目为NA |
分析 A.氨气分子中含有11个电子,17g氨气的物质的量为1mol,含有10mol电子;
B.根据n=$\frac{m}{M}$计算出臭氧中含有氧原子的物质的量,然后可计算出含有氧原子的数目;
C.铁与盐酸反应生成的是亚铁离子;
D.标况下水的状态不是气态.
解答 解:A.17g NH3的物质的量为:$\frac{17g}{17g/mol}$=1mol,1mol氨气分子中含有10mol电子,含有的电子数是10NA,故A错误;
B.32 g O3中含有氧原子的物质的量为:$\frac{32g}{16g/mol}$=2mol,含有氧原子个数为2NA,故B正确;
C.5.6gFe的物质的量为:$\frac{5.6g}{56g/mol}$=0.1mol,0.1molFe与足量盐酸完全反应生成0.1mol氯化亚铁,Fe失去0.2mol电子,铁失去的电子数为0.2NA,故C错误;
D.标准状况下水不是气体,不能使用标况下的气体摩尔体积计算,故D错误;
故选B.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,明确标况下气体摩尔体积的使用条件为解答关键,注意熟练掌握以物质的量为中心的各化学量与阿伏加德罗常数的关系,试题有利于提高学生灵活运用基础知识解决实际问题的能力.


 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 正极反应式为:O2+2H2O+4e-═4OH- | |
| B. | 工作一段时间后,电解质溶液中KOH的物质的量不变 | |
| C. | 该燃料电池的总反应式为:2H2+O2═2H2O | |
| D. | 该电池工作时每消耗1molO2,有2mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解饱和食盐水时阳极的电极反应式为:2Cl--2e-═Cl2↑ | |
| B. | 氢氧燃料电池的负极反应式:O2+2H2O+4e-═4OH- | |
| C. | 粗铜精炼时,与电源正极相连的是铜 | |
| D. | 钢铁发生电化学腐蚀的正极反应式:Fe-2e-═Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
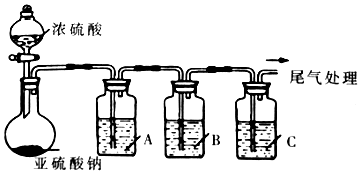
| 试剂 | 作用 | |
| A | 验证SO2的还原性 | |
| B | Na2S溶液 | |
| C | 品红溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某化学兴趣小组为探究铜与浓硫酸的反应以及SO2的性质,用右图所示装置进行有关实验.请回答下列问题:
某化学兴趣小组为探究铜与浓硫酸的反应以及SO2的性质,用右图所示装置进行有关实验.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
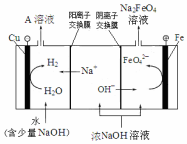 高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂.
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 焰色反应是黄色 | |
| B. | 溶液有咸味 | |
| C. | 取少量溶液于试管中,滴加稀硝酸酸化的硝酸银溶液,出现白色沉淀 | |
| D. | 既出现A中的现象,又出现C中的现象 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com