
【题目】宝鸡被誉为“青铜器之乡”,出土了大盂鼎、毛公鼎、散氏盘等五万余件青铜器。研究青铜器(含Cu、Sn等)在潮湿环境中发生的腐蚀对于文物保护和修复有重要意义。下图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图,下列说法不正确的是
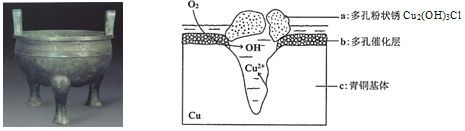
A. 青铜器发生电化学腐蚀,图中c作负极,被氧化
B. 正极发生的电极反应为O2+ 4e-+2H2O=4OH-
C. 环境中的Cl- 与正、负两极反应的产物作用生成a的离子方程式为2Cu2++3OH-+Cl-=Cu2 (OH)3Cl↓
D. 若生成0.2 mol Cu2(OH)3Cl,则理论上消耗的O2体积为4.48L
科目:高中化学 来源: 题型:
【题目】将m g含氧化铁、氧化铜和氧化亚铁的样品投入物质的量浓度为1 mol/L的2 L盐酸中恰好完全反应,若向等质量的该样品中通入足量的氢气并加热,充分反应后所得金属的质量是( )
A.(m-16)g B.(m+16)g C.(m-32 )g D.16g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 室温下,不能将浓硫酸盛放在铁桶中
B. 现在“点石成金”术石墨变成金刚石属于物理变化
C. 配制溶液定容时,仰视容量瓶刻度线,所配溶液浓度偏高
D. 工业上冶炼铝时加入冰晶石的作用是降低氧化铝的熔融温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,对于密闭容器中进行的反应:2SO2(g) + O2(g) ![]() 2SO3(g),下列说法能充分说明该反应已达到化学平衡状态的是
2SO3(g),下列说法能充分说明该反应已达到化学平衡状态的是
A. 正、逆反应速率都等于零 B. SO2、O2、SO3的浓度相等
C. SO2、O2、SO3在容器中共存 D. SO2、O2、SO3的浓度均不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:
Ⅰ.配制100mL 0.10mol/L NaOH标准溶液.
Ⅱ.取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用的标准NaOH溶液进行滴定.重复上述滴定操作2~3次,记录数据如下.
实验编号 | NaOH溶液的浓度(mol/L) | NaOH溶液的体积(mL) | 待测盐酸溶液的体积(mL) |
1 | 0.10 | 20.00 | |
2 | 0.10 | 22.46 | 20.00 |
3 | 0.10 | 22.54 | 20.00 |
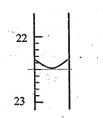
(1)第1次实验滴定前液面在0刻度,滴定后如图所示,则第一次实验滴定完用去NaOH溶液的体积记录为_________mL。滴定达到终点的现象是_____________________。
(2)根据上述数据,可计算出该盐酸的浓度为___________。
(3)在上述实验中,下列操作会造成测定结果偏高的有___________
A.滴定终点时俯视读数
B.酸式滴定管使用前,水洗后未用待测稀盐酸溶液润洗
C.锥形瓶水洗后未干燥
D.配制NaOH标准溶液,定容时仰视
E.碱式滴定管尖嘴部分有气泡,滴定后消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于冶炼像钠、钙、镁、铝这样活泼的金属,电解法几乎是唯一可行的工业方法。下列有关说法中正确的是
A.电解熔融NaOH可生成金属钠、O2以及H2
B.电解熔融CaCl2时,金属钙在阳极生成
C.可用电解饱和MgCl2溶液的方法获得金属镁
D.电解熔融Al2O3制备金属铝时,要加入冰晶石,使Al2O3在较低温度下熔解。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Zn2+的4s轨道和4p轨道可以形成sp3杂化轨道,那么[ZnCl4]2-的立体构型为
A.直线形 B.平面正方形 C.正四面体形 D.正八面体形
答
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为2.0L的的恒容密闭容器中发生如下反应:PCl5(g)![]() PCl3(g)+Cl2(g)
PCl3(g)+Cl2(g)
编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | 达到平衡所需时(s) | |
PCl5(g) | PCl3(g) | Cl2(g) | |||
Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t1 |
Ⅱ | 320 | 0.80 | t2 | ||
Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t3 |
下列说法正确的是
A.平衡常数K:容器Ⅱ>容器Ⅲ
B.反应到达平衡时,PCl5的转化率:容器Ⅱ>容器Ⅰ
C.反应到达平衡时,容器I中的平均速率为v(PCl5)=0.1/t1 mol/(L·s)
D.起始时向容器Ⅲ中充入PCl5 0.30 mol、PCl3 0.45 mol和Cl2 0.10 mol,则反应将向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用浓盐酸与二氧化锰反应制取氯气,下列有关说法中正确的是(气体体积在.标况下测定)( )
A. 若提供0.4 mol HCl,MnO2过量,则可制得氯气4.48 L
B. 若提供0.4 mol HCl,MnO2过量,则转移电子数一定为0.1mol
C. 若有0.4 mol HCl参加反应,则可制得氯气2.24 L
D. 若有0.4 mol HCl被氧化,则可制得氯气2.24 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com