


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
| A、1.0L 1.0mol?L-1的NaAlO2水溶液中含有的氧原子数为2NA |
| B、1mol醋酸的质量与NA个醋酸分子的质量一定相等 |
| C、2.24L CO2中含有的原子数为0.3NA |
| D、0.1mol/L 的NaCl溶液中,Na+与Cl-离子总数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、CH4+Cl2
| |||
B、CH3Cl+Cl2
| |||
C、CH4+2O2
| |||
D、CH2=CH2+H2
|
查看答案和解析>>
科目:高中化学 来源: 题型:
+ 4 |
2- 4 |
+ 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
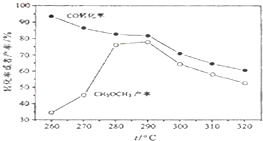 (除零班外其它班做) 一碳化学是国际研究的热点,有研究者在催化剂和压强为5.0MPa的条件下由H2和CO直接制备二甲醚,其反应为:2CO(g)+4H2(g)═CH3-O-CH3(g)+H2O(g),有关图象如图:
(除零班外其它班做) 一碳化学是国际研究的热点,有研究者在催化剂和压强为5.0MPa的条件下由H2和CO直接制备二甲醚,其反应为:2CO(g)+4H2(g)═CH3-O-CH3(g)+H2O(g),有关图象如图:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、增大浓度 | B、增大压强 |
| C、升高温度 | D、使用催化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com