
【题目】向等物质的量浓度的NaOH和Na2CO3的混合溶液中加入稀盐酸.下列离子方程式可能与事实相符的是
A.OH﹣+2CO32﹣+3H+→2HCO3﹣+H2O
B.2OH﹣+CO32﹣+3H+→HCO3﹣+2H2O
C.2OH﹣+CO32﹣+4H+→CO2↑+3H2O
D.OH﹣+CO32﹣+3H+→CO2↑+2H2O
【答案】BD
【解析】
A.设NaOH和Na2CO3的物质的量都为1mol,则加入盐酸少量,先发生反应:OH+H+=H2O,1mol氢氧化钠消耗1mol盐酸,再发生反应![]() ,将两个方程式相加得:
,将两个方程式相加得:![]() ,故A错误;
,故A错误;
B.设NaOH和Na2CO3的物质的量都为2mol,则加入盐酸少量,先发生反应:2OH+2H+=2H2O,2mol氢氧化钠消耗2mol盐酸,再发生反应![]() ,盐酸不足之消耗1mol碳酸钠,将两个方程式相加得:
,盐酸不足之消耗1mol碳酸钠,将两个方程式相加得:![]() ,故B正确;
,故B正确;
C.设NaOH和Na2CO3的物质的量都为2mol,2mol氢氧化钠消耗2mol氢离子,剩余2mol氢离子与2mol碳酸钠反应生成2mol碳酸氢根离子,离子方程式应为![]() ,即
,即![]() ,故C错误;
,故C错误;
D.设NaOH和Na2CO3的物质的量都为1mol,则加入盐酸过量,先发生反应:OH+H+=H2O,1mol氢氧化钠消耗1mol盐酸,再发生反应![]() ,将两个方程式相加得:
,将两个方程式相加得:![]() ,故D正确;
,故D正确;
故答案为:BD。


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:
【题目】近年来,为应对温室气体排放问题和日益增长的能源需求问题,CO2综合利用技术作为潜在的解决方案受到了研究者的广泛关注。请按照要求回答问题
(1)CO常用于工业冶炼金属,下图是在不同温度下CO还原四种金属氧化物达平衡后气体中![]() 与温度(t)的关系曲线图。下列说法正确的是________。(填序号)
与温度(t)的关系曲线图。下列说法正确的是________。(填序号)
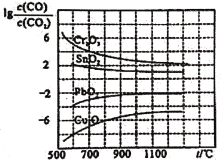
A 工业上可以通过增高反应装置来延长矿石和CO接触的时间,减少尾气中CO的含量
B CO不适宜用于工业冶炼金属铬(Cr)
C 工业冶炼金属铜(Cu)时较低的温度有利于提高CO的利用率
D CO还原PbO2的反应△H>0
(2)一定条件下Pd-Mg/SiO2催化剂可使CO2 “甲烷化”变废为宝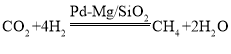 ,最佳催化温度是200℃~300℃左右,超过300℃催化剂会完全失活、反应停止。向密闭容器通入v(CO2):v(H2)=1:4的反应气体,常温进料开始加热,画出生成甲烷的量随温度的变化曲线_________。
,最佳催化温度是200℃~300℃左右,超过300℃催化剂会完全失活、反应停止。向密闭容器通入v(CO2):v(H2)=1:4的反应气体,常温进料开始加热,画出生成甲烷的量随温度的变化曲线_________。
(3)在载人航天器中应用电化学原理,以Pt为阳极,Pb(CO2的载体)为阴极KHCO3溶液为电解质溶液,还原消除航天器内CO2同时产生O2和新的能源CO,则阴极的电极反应式为___________;室温下H2CO3电离常数约为K1=4×10-7,K2=5×10-11,则0.025 mol·L-1的H2CO3溶液的pH约等于__________(不考虑第二步电离和H2O的电离)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应:N2(g)+O2(g)![]() 2NO(g),曲线a表示该反应在温度T℃时N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。叙述正确的是( )
2NO(g),曲线a表示该反应在温度T℃时N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。叙述正确的是( )

A.温度T℃时,该反应的平衡常数K=![]()
B.温度T℃时,混合气体的密度不变即达到平衡状态
C.曲线b对应的条件改变可能是加入了催化剂
D.若曲线b改变的条件是温度,则该正反应放热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图是恒温下某化学反应的反应速率随反应时间变化的示意图。下列叙述与示意图不相符合的是( )
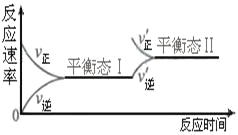
A. 反应达平衡时,正反应速率和逆反应速率相等
B. 该反应达到平衡态Ⅰ后,增大反应物浓度,平衡发生移动,达到平衡态Ⅱ
C. 该反应达到平衡态后,减小反应物浓度,平衡发生移动,达到平衡态Ⅱ
D. 同一种反应物在平衡态Ⅰ和平衡Ⅱ时浓度不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白:
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视________。直到因加入一滴盐酸后,溶液由黄色变为橙色,并________为止。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是(____)。
A 酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B 滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C 酸式滴定管在滴定前有气泡,滴定后气泡消失
D 读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则起始读数为________mL,终点读数为________mL;所用盐酸溶液的体积为________mL。
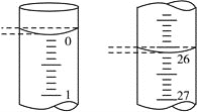
(4)某学生根据3次实验分别记录有关数据如表:
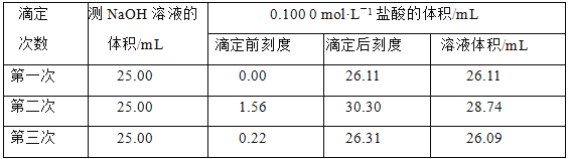
依据上表数据列式计算该NaOH溶液的物质的量浓度_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验。
实验一 制取氯酸钾和氯水
利用如图所示的实验装置进行实验。

(1)制取实验结束后,取出B中试管冷却结晶,过滤,洗涤。该实验操作过程需要的玻璃仪器有______。
(2)若对调B和C装置的位置,_____(填“可能”或“不可能”)提高B中氯酸钾的产率。
实验二 氯酸钾与碘化钾反应的研究
(3)在不同条件下KClO3可将KI氧化为I2或KIO3。该小组设计了系列实验研究反应条件对反应产物的影响,其中系列a实验的记录表如下(实验在室温下进行):
试管编号 | 1 | 2 | 3 | 4 |
0.20molL-1KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
6.0molL-1H2SO4/mL | 0 | 3.0 | 6.0 | 9.0 |
蒸馏水/mL | 9.0 | 6.0 | 3.0 | 0 |
实验现象 |
①系列a实验的实验目的是______。
②设计1号试管实验的作用是______。
③若2号试管实验现象是溶液变为黄色,取少量该溶液加入______溶液显蓝色。
实验三 测定饱和氯水中氯元素的总量
(4)根据下列资料,为该小组设计一个简单可行的实验方案(不必描述操作过程的细节):_____。
资料:①次氯酸会破坏酸碱指示剂;
②次氯酸或氯水可被SO2、H2O2和FeCl2等物质还原成Cl-。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中一定量的混合气体发生反应xA(g)+yB(g)![]() zC(g),平衡时测得A的浓度为0.50 mol/L。保持温度不变.将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.30 mol/L。下列有关判断正确的是
zC(g),平衡时测得A的浓度为0.50 mol/L。保持温度不变.将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.30 mol/L。下列有关判断正确的是
A.B的转化率降低B.平衡向正反应方向移动
C.x+y<zD.C的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸式滴定管准确移取25.00mL某未知浓度的盐酸溶液于一洁净的锥形瓶中,然后用0.2000mol·L-1的氢氧化钠溶液(指示剂为酚酞)滴定。滴定结果如下所示:
NaOH溶液起始读数 | NaOH终点读数 | |
第一次 | 0.10mL | 18.60mL |
第二次 | 0.30mL | 19.00mL |
(1)准确配制0.2000mol·L-1的氢氧化钠溶液250mL,需要的主要仪器除量筒、烧杯、玻璃棒外,还必须用到的玻璃仪器有___。
(2)根据以上数据可以计算出盐酸的物质的量浓度为___ mol·L-1。(保留4位有效数字)
(3)用0.2000mol·L-1标准氢氧化钠溶液滴定待测盐酸溶液,滴定时左手控制碱式滴定管的玻璃球,右手不停摇动锥形瓶,眼睛注视___,直到滴定终点。
(4)达到滴定终点的标志是___。
(5)以下操作造成测定结果偏高的原因可能是___ (填字母代号)。
A.未用标准液润洗碱式滴定管
B.滴定终点读数时,俯视滴定管的刻度,其他操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 1.00mol NaCl中含有6.02×1023个NaCl分子
B. 1.00mol NaCl中,所有Na+的最外层电子总数为8×6.02×1023
C. 欲配置1.00L ,1.00mol.L-1的NaCl溶液,可将58.5g NaCl溶于1.00L水中
D. 电解58.5g熔融的NaCl,能产生22.4L氯气(标准状况)、23.0g金属钠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com