
 (1)NF3分子中N原子的杂化轨道类型为sp3,该分子的空间构型为三角锥形
(1)NF3分子中N原子的杂化轨道类型为sp3,该分子的空间构型为三角锥形分析 (1)根据NF3分子中N原子的价层电子对数判断杂化轨道类型,根据价层电子对互斥理论确定NF3空间构型;
(2)[Cu(NH3)4]SO4属于配合物,所以金属阳离子提供空轨道,配体提价孤电子对,分子晶体熔沸点低,比较易溶于非极性溶剂;
(3)根据均摊法可知,该晶胞中含有铜原子数为$8×\frac{1}{8}+6×\frac{1}{2}$=4,根据$ρ=\frac{m}{V}$可计算得密度;
解答 (1)根据价层电子对理论知,NF3分子中N原子价层电子对个数=$\frac{5+3}{2}$=4,所以N原子采用sp3杂化,氮原子周围有一个孤电子对,所以其空间构型为三角锥形,
故答案为:sp3;三角锥形;
(2)[Cu(NH3)4]SO4属于配合物,金属阳离子提供空轨道,氨分子是配体提价孤电子对,所以氨分子中的氮原子提价孤电子对,Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,可知Fe(CO)x属于分子晶体,
故答案为:N;分子晶体;
(3)根据均摊法可知,该晶胞中含有铜原子数为$8×\frac{1}{8}+6×\frac{1}{2}$=4,晶胞的体积为(d×10-7cm)3,所以密度为$ρ=\frac{m}{V}$=$\frac{\frac{4×64}{{N}_{A}}}{(d×1{0}^{-7})^{3}}$g/cm3=$\frac{4×64}{{N}_{A}(d×1{0}^{-7})^{3}}$g/cm3,
故答案为:$\frac{4×64}{{N}_{A}(d×1{0}^{-7})^{3}}$;
点评 本题主要考查原子结构与位置关系、杂化轨道、分子空间构型、晶体类型与性质、晶胞结构与计算等,注意利用均摊法进行计算,难度不大.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙醇和乙烯 | B. | 甲醛和葡萄糖 | C. | 乙烯和乙酸乙酯 | D. | 丙烷和乙醛 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数:c>b | B. | 氢化物的稳定性:H2Y<HZ | ||
| C. | 离子的还原性:Y2-<Z- | D. | 原子半径:r(X)<r(W) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度 | B. | 降低温度 | C. | 使用催化剂 | D. | 增大CO浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
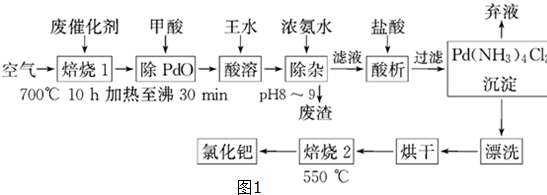
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | XeF4被氧化 | B. | 该反应是非氧化还原反应 | ||
| C. | XeF4既是氧化剂又是还原剂 | D. | CH3-CH=CH2是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
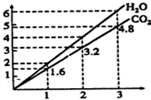 两种气态烃组成的混合气体,完全燃烧后得到C02和H2O的物质的量随着混合烃物质的量的变化如图所示.则下列对混合烃的判断正确的是( )
两种气态烃组成的混合气体,完全燃烧后得到C02和H2O的物质的量随着混合烃物质的量的变化如图所示.则下列对混合烃的判断正确的是( )| A. | ②⑤ | B. | ②④ | C. | ③④ | D. | ①③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com