
| A、铁片插入稀硫酸中 2Fe+6H+=2Fe3++3H2↑ |
| B、氢氧化镁与稀硫酸反应 H++OH-=H2O |
| C、向硝酸银溶液中加盐酸 AgNO3+Cl-=AgCl↓+NO3- |
| D、用氢氧化铝治疗胃酸(HCl)过多 Al(OH)3+3H+=Al3++3H2O |


科目:高中化学 来源: 题型:
 硝酸是一种重要的化工原料.
硝酸是一种重要的化工原料.| 15 |
| 16 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 弱酸 | H2CO3 | H2SO3 | HClO |
| 电离平衡常数 (25℃) |
K1=4.30×l0-7 | K1=1.54×l0-2 | K=2.95×l0-8 |
| K2=5.61×l0-11 | K2=1.02×l0-7 |
| A、ClO-+CO2+H2O→HClO+HCO3- |
| B、SO32-+CO2+H2O→HSO3-+HCO3- |
| C、2ClO-+SO2+H2O→2HClO+SO32- |
| D、2HSO3-+CO32-→2SO32-+CO2+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:

 有多种同分异构体,其中苯环上只有一个侧链的同分异构体的结构简式是
有多种同分异构体,其中苯环上只有一个侧链的同分异构体的结构简式是查看答案和解析>>
科目:高中化学 来源: 题型:
| O | - 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| R | ||
| T | X |
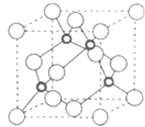
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,23g NO2含有NA个氧原子 |
| B、标准状况下,11.2L SO3中含有的分子数为0.5NA |
| C、1mol Cl2做氧化剂转移的电子数是NA |
| D、1L0.1mol?L-1的氨水中含OH-离子数为0.1NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+ 比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等子中子数.R是由A、D两元素形成的离子化合物,其中A+与D2-离子数之比为2:1.请回答下列问题:
有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+ 比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等子中子数.R是由A、D两元素形成的离子化合物,其中A+与D2-离子数之比为2:1.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com