(2011?江山市模拟)(背景材料)氮化铝(AlN)陶瓷是一种类金刚石氮化物的新型无机非金属材料,最高可稳定到2200℃.导热性好,热膨胀系数小,是良好的耐热冲击材料.抗熔融金属侵蚀的能力强,是熔铸纯铁、铝或铝合金理想的坩埚材料.氮化铝还是电绝缘体,介电性能良好,用作电器元件也很有希望.超细氮化铝粉末被广泛应用于大规模集成电路生产领域.其制取原理为:
Al
2O
3+3C+N
2 2AlN+3CO
(问题探究)某化学研究性学习小组成员根据氮化铝的制取原理,进行了如下探究.
问题1、在制取氮化铝时由于反应不完全,氮化铝产品中所含杂质除了碳以外还可能存在
氧化铝
氧化铝
.
问题2、为测定该产品中有关成分的含量,甲、乙两同学设计了以下两个实验:
(1)甲同学:称取10.00g样品,将其加入过量的氢氧化钠溶液中共热并蒸干,AlN跟氢氧化钠溶液反应生成NaAlO
2,并放出氨气3.36L(标准状况).
①上述反应的化学方程式为
AlN+NaOH+H2O=NaAlO2+NH3↑
AlN+NaOH+H2O=NaAlO2+NH3↑
.
②该样品中的AlN的质量分数为
61.5%
61.5%
.
(2)乙同学:称取10.00g样品置于反应器中,通入2.016L(标准状况)O
2,在高温下充分反应后测得气体的密度为1.34g?L
-1(已折成标准状况,AlN不跟O
2反应).该样品中含杂质碳
1.92
1.92
g.
问题3、丙同学受到甲、乙同学实验的启发,认为测定某氮化铝中含有碳或氧化铝杂质,可用图中I的一些装置来进行检验,根据AlN与NaOH溶液反应所生成氨气的体积来测定样品中氮化铝的质量分数,并根据实验现象来确定杂质的成分(实验中导管体积忽略不计)
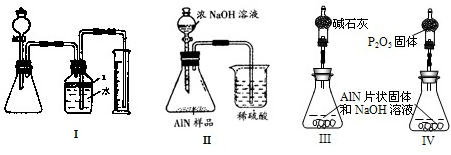
(1)实验有关操作为:①往锥形瓶中放入适量的AlN样品:②从分液漏斗往锥形瓶中加入过量的浓NaOH;③检验装置的气密性;④测定收集到水的体积.
正确的操作顺序为
③①②④
③①②④
.
(2)本试验中检查装置气密性的方法是
关闭分液漏斗活塞,微热锥形瓶,广口瓶中右侧导管水柱上升,恒温时水柱并不回落
关闭分液漏斗活塞,微热锥形瓶,广口瓶中右侧导管水柱上升,恒温时水柱并不回落
.
(3)广口瓶中的试剂X可最好选用
C
C
(填选项的标号).
A、苯 B、酒精 C、植物油 D、CCl
4(4)广口瓶的液体没有装满(上方留有少量空间),实验测得NH
3的体积将
不变
不变
(填偏大、偏小或不变).
(5)若实验中测得样品的质量为wg,氨气的体积为aL(标况下),则样品中AlN的质量分数为
(AlN的式量为41).
(6)实验结束后,若观察到锥形瓶中还有固体,则样品中含有的杂质是
碳
碳
,为了测定是否含有其它杂质,则还需要哪些简单数据
碳的质量
碳的质量
.
问题4、丁同学认为,丙同学的实验方法,可能因气体体积测量不准,导致误差较大.建议改用图9中的Ⅱ装置进行同样实验,通过测定烧杯中硫酸的增重来确定样品中AlN的质量分数.你认为是否可行?
不可行
不可行
(填入“可行”、“不可行”),原因是
II中NH3极易被吸收,发生倒吸现象,同时氨气中含有水蒸气,影响氨气质量的测定
II中NH3极易被吸收,发生倒吸现象,同时氨气中含有水蒸气,影响氨气质量的测定
.最简单的改进方法为
在装置之间添加盛有碱石灰的干燥管,烧杯导管的末端接一倒扣的漏斗来吸收氨气
在装置之间添加盛有碱石灰的干燥管,烧杯导管的末端接一倒扣的漏斗来吸收氨气
.
问题5、戊同学仔细思考了丁同学的装置后,认为此装置所测测得的样品中AlN含量偏小.其原因是
反应产生的氨气不可能被完全吸收
反应产生的氨气不可能被完全吸收
.若忽略此原因的话,只要用图9中的III或IV两个装置中的一种,只需进行简单而又必要的数据测定,可比较准确地确定样品中AlN的质量分数.较合理的装置为
Ⅲ
Ⅲ
(填代号).你认为戊同学的装置是否还有缺陷?
有
有
.若有,所测结果将偏高或偏低
偏低
偏低
,应作如何改进?
应再接一个与IV装置中完全相同的干燥管(或再接一个装有碱石灰的干燥管也行)
应再接一个与IV装置中完全相同的干燥管(或再接一个装有碱石灰的干燥管也行)
.(若无缺陷后两此格可不填).

 ,V=n×Vm,根据1个H2S中含有2个氢原子以及 H2S的物质的量;
,V=n×Vm,根据1个H2S中含有2个氢原子以及 H2S的物质的量; NA来分析;
NA来分析;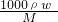 ;
; =2mol;在标准状况下的体积约为V=2mol×22.4L/mol=44.8L; 0.1mol H2S中约0.1mol×2×6.02×1023=1.204×1023;故答案为:2;44.8;1.204×1023
=2mol;在标准状况下的体积约为V=2mol×22.4L/mol=44.8L; 0.1mol H2S中约0.1mol×2×6.02×1023=1.204×1023;故答案为:2;44.8;1.204×1023 NA知,质量相同的两种气体中含有的分子个数之比等于摩尔之比的反比,所以两份质量相同的NH3和H2S的分子数之比为2:1,故答案为:2:1;
NA知,质量相同的两种气体中含有的分子个数之比等于摩尔之比的反比,所以两份质量相同的NH3和H2S的分子数之比为2:1,故答案为:2:1;  ×x,
×x,

 导学全程练创优训练系列答案
导学全程练创优训练系列答案