
设NA为阿伏加德罗常数的值。下列叙述正确的是
A.标准状况下,0.56 L丙烷中含有共价键的数目为0.2NA
B.常温常压下,6.4 g氧气和臭氧中含有的原子总数为0.4NA
C.5.6 g铁与一定量硝酸恰好反应,转移的电子数目一定为0.3NA
D.常温下,2 L 0.1 mol·L-1Na2CO3溶液中,含有的CO32-离子数为0.2NA
科目:高中化学 来源:2016-2017学年江西省高一上第一次月考化学卷(解析版) 题型:选择题
某电解质溶液中可能大量存在H+、Mg2+、CO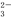 、OH-、 Cl-等离子中的几种,下列有关说明正确的是
、OH-、 Cl-等离子中的几种,下列有关说明正确的是
A.一定没有Mg2+、CO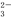 、OH- B.一定无Cl-
、OH- B.一定无Cl-
C.还需要进一步确认的离子是H+、Cl- D.无法判断溶液中含有何种阳离子
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆一中高一上10月月考化学试卷(解析版) 题型:选择题
离子方程式BaCO3+2H+=CO2↑+H2O+Ba2+中的H+能代表的物质是( )
①HCl ②H2SO4 ③HNO3 ④NaHSO4 ⑤CH3COOH
A. ②④⑤ B.①④⑤ C.①⑤ D.①③
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上第一次测试化学试卷(解析版) 题型:推断题
非诺洛芬是一种治疗类风湿性关节炎的药物,可通过以下方法合成:
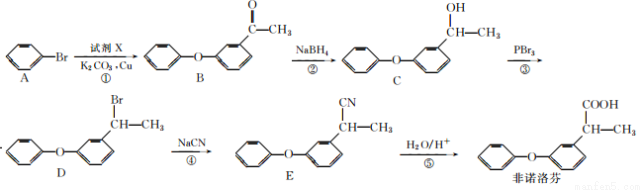
请回答下列问题:
(1)非诺洛芬中的含氧官能团为______________(填名称)。
(2)反应①中加入的试剂X的分子式为C8H8O2,X的结构简式为______________。
(3)在上述五步反应中,属于取代反应的是________(填序号)。
(4)B的一种同分异构体满足下列条件:
Ⅰ.能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应。
Ⅱ.分子中有6种不同化学环境的氢,且分子中含有两个苯环。
写出该同分异构体的结构简式:______________。
(5)根据已有知识并结合相关信息,写出以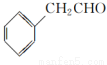 为原料制备
为原料制备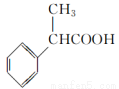 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上第一次测试化学试卷(解析版) 题型:选择题
下列图示与对应的叙述相符的是
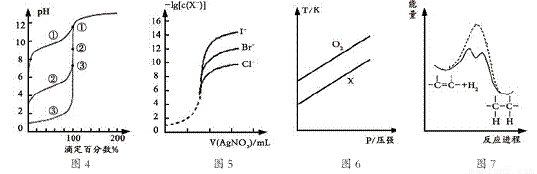
A. 用0.1000mol/LNaOH溶液分别滴定浓度相同的三种一元酸,由图4曲线确定①的酸性最强
B. 用0.0100mol/L硝酸银标准溶液,滴定浓度均为0.1000mol/LCl-、Br-及I-的混合溶液,由图5曲线,可确定首先沉淀的是Cl-
C. 在体积相同的两个密闭容器中,分别充入相同质量O2和X气体,由图6可确定X可能是CH4气体
D. 由图7可说明烯烃与H2加成反应是放热反应,虚线表示在有催化剂的条件下进行
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
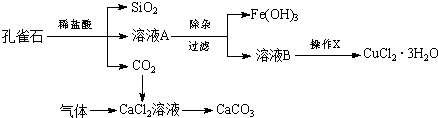
| 物质 | pH (开始沉淀) | pH(完全沉淀) |
| Fe(OH)3 | 1.9 | 3.2 |
| Fe(OH)2 | 7.0 | 9.0 |
| Cu(OH)2 | 4.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 因为氯化铝是分子晶体,所以工业制备金属铝不采用电解氯化铝溶液,但工业制取金属镁可以采用电解氯化镁溶液的方法 | |
| B. | 25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体c(Mg2+)增大 | |
| C. | 鸡蛋清中加入2滴1%醋酸铅溶液后会产生沉淀,因为蛋白质发生了变性 | |
| D. | 在BaSO4悬浊液中加入饱和碳酸钠溶液,过滤、洗涤得固体,再加盐酸产生气体.可证明Ksp(BaSO4)<Ksp(BaCO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
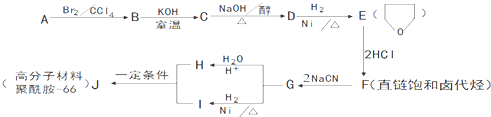
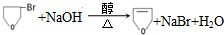 .
.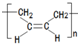 .
. .
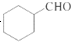
.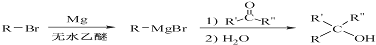
 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
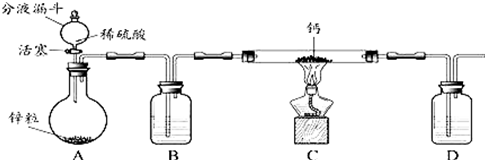
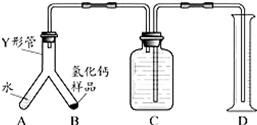
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com