
某合金(仅含铜、铁)中铜和铁的物质的量之和为y mol,其中Cu的物质的量分数为a,将其全部投入50mL b mol•L﹣1的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物).请回答:
(1)若金属有剩余,在溶液中再滴入硫酸后,金属会 ;
A.继续溶解 B.不溶解
(2)若金属全部溶解,则溶液中一定含有较多的离子是 ;
(3)当溶液中金属离子只有Fe3+、Cu2+时,则a与b的关系为: .
考点:
化学方程式的有关计算.
专题:
计算题.
分析:
(1)溶液中有硝酸根时,再加入酸,溶液具有强氧化性,金属能溶解;
(2)反应生成硝酸铜、铁的硝酸盐,Fe可能以Fe2+或Fe3+形式存在,或二者都有;
(3)根据Cu的物质的量分数计算合金中Cu、Fe的物质的量,反应中起酸作用的酸性生成Fe(NO3)3和Cu(NO3)2,根据守恒计算其酸作用的硝酸,根据电子转移守恒计算起氧化剂作用的硝酸,两部分硝酸之和为消耗的硝酸,应小于或等于50mL bmol•L﹣1的硝酸溶液中含有的HNO3.
解答:
解:(1)溶液中有硝酸根时,再加入酸,溶液具有强氧化性,金属能继续溶解,故A正确,故答案为:A;
(2)反应生成硝酸铜、铁的硝酸盐,Fe可能以Fe2+或Fe3+形式存在,或二者都有,故溶液中溶液中一定含有较多的离子是:Cu2+、NO3﹣,
故答案为:Cu2+、NO3﹣;
(3)合金中Cu的物质的量分数为a,则合金中Cu为ya mol、Fe为y(1﹣a) mol,
起酸性的硝酸生成Fe(NO3)3和Cu(NO3)2中,故起酸性作用的硝酸为[3y(1﹣a)+2ya]mol,
作氧化性的硝酸生成NO,得到的电子等于Fe、Cu失去的电子,所以作氧化性的硝酸为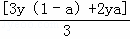 mol,消耗硝酸的总量为[3y(1﹣a)+2ya]mol+
mol,消耗硝酸的总量为[3y(1﹣a)+2ya]mol+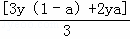 mol=4y(1﹣
mol=4y(1﹣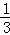 a),
a),
故4y(1﹣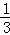 a)≤0.05L×bmol/L,
a)≤0.05L×bmol/L,
整理得,b≥80y(1﹣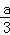 ),
),
故答案为:b≥80y(1﹣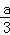 ).
).
点评:
本题考查硝酸的性质、混合物的有关计算,难度中等,注意守恒思想在解题中的运用.


科目:高中化学 来源: 题型:
下列方法能达到实验目的是( )
A. 用浓硫酸干燥NH3
B. 用四氯化碳萃取碘水中的碘单质
C. 用NaOH固体干燥Cl2
D. 将Na在O2中燃烧以制取Na2O
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室配制500mL 2mol/L的H2SO4溶液.
(1)500mL 2mol/L的H2SO4溶液中所含溶质的质量是 g.
(2)配制时,所需仪器应该有烧杯、玻璃棒、量筒、 、 .
(3)容量瓶在使用前,首先应检查 .
(4)此实验中,玻璃棒的两个作用分别是 、 .
(5)下列操作会使配制的溶液浓度偏低的是 (选填序号)
A.没有将洗涤液转移到容量瓶B.定容时俯视刻度线
C.容量瓶洗净后未干燥D.转移过程中有少量溶液溅出.
查看答案和解析>>
科目:高中化学 来源: 题型:
将SO2通入BaCl2溶液并不产生沉淀,而通入另一种气体后可以产生白色沉淀.则右侧Y形管中放置的药品组合不符合要求的是(必要时可以加热)( )
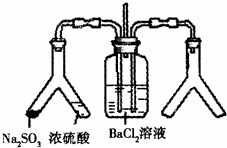
|
| A. | 石灰石和稀硝酸 | B. | CaO和氯化铵 |
|
| C. | Cu和浓硝酸 | D. | Na2O2和食盐水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
1.28g铜投入一定量浓HNO3中,铜完全溶解,生成气体颜色越来越浅,共收集到448mL气体(标况).将盛有此气体的容器倒扣在水中,通入标况下一定体积的O2,恰好使气体完全溶于水中,则通入O2的体积是( )
|
| A. | 168mL | B. | 224mL | C. | 336mL | D. | 504mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与科学、技术、社会、环境密切相关,下列有关说法正确的是( )
|
| A. | 人造纤维、合成纤维和光导纤维都是有机高分子化合物 |
|
| B. | 加热能杀死甲型H1N1流感病毒是因为病毒的蛋白质受热变性 |
|
| C. | 棉、麻、丝、毛燃烧后都只生成CO2和H2O |
|
| D. | 铝合金的大量使用归功于人们能使用焦炭等还原剂从氧化铝中获得铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化合物的核磁共振氢谱中出现三组峰的是( )
|
| A. | 2,2,3,3﹣四甲基丁烷 | B. | 2,3,4﹣三甲基戊烷 |
|
| C. | 3,4﹣二甲基己烷 | D. | 2,5﹣二甲基己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质的转化在给定条件下能实现的是( )
①NaAlO2(aq) AlCl3
AlCl3 Al
Al
②NH3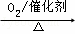 NO
NO HNO3
HNO3
③NaCl(饱和)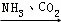 NaHCO3
NaHCO3 Na2CO3
Na2CO3
④FeS2 SO3
SO3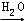 H2SO4.
H2SO4.
A. ②③ B. ①④ C. ②④ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作正确的是( )
|
| A. | 将氢氧化钠固体放在滤纸上称量 |
|
| B. | 用10mL量筒量取8.58mL蒸馏水 |
|
| C. | 制取氯气时,用二氧化锰与浓盐酸在常温下反应,并用排水集气法收集 |
|
| D. | 配制氯化铁溶液时,将一定量氯化铁溶解在较浓的盐酸中,再用水稀释到所需浓度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com