
| A. | ①②④⑤ | B. | ②④⑤ | C. | ②⑤ | D. | ①③⑤ |
分析 ①可逆反应达到平衡时,平衡向着正向移动,则生成物的量一定增加;
②前者酸过量,过量的醋酸抑制了水的电离,后者恰好生成氯化钠,不影响水的电离;
③相铵根离子与银离子反应,导致氯化银的溶解平衡向着正向移动,而氯离子对氯化银的溶解平衡起到了抑制作用;
④任何电解质溶液中都存在电荷守恒和物料守恒,根据电荷守恒和物料守恒判断;
⑤电离平衡常数Ka=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$,Kh=$\frac{c(C{H}_{3}COOH)•c(O{H}^{-})}{C(C{H}_{3}CO{O}^{-})}$,Kw=c(H+).c(OH-).
解答 解:①可逆反应达到平衡时,改变条件后平衡向着正向移动,生成物的物质的量增大,在生成物的产量一定增加,故①正确;
②常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合后形成溶液a,由于醋酸为弱酸,则混合液中醋酸过量,过量的醋酸抑制了水的电离;等浓度的盐酸与NaOH溶液等体积混合后x形成溶液b,b为NaCl溶液,钠离子和硫离子不影响水的电离,所以水的电离程度a<b,故②错误;
③常温下,AgCl在同物质的量浓度的氨水和NaCl溶液中的溶解度比较,由于铵根离子与银离子反应促进了溶解平衡向着氯化银溶解的方向移动,而氯离子抑制了氯化银的溶解,所以氯化银的溶解度前者较大,故③正确;
④溶液呈中性,则c(H+)=c(OH-),根据溶液中的电荷守恒得:2c(CO32-)+c(HCO3ˉ)=c(Na+)=0.2mol•L-1,故④错误;
⑤电离平衡常数Ka=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$,Kh=$\frac{c(C{H}_{3}COOH)•c(O{H}^{-})}{C(C{H}_{3}CO{O}^{-})}$,Kw=c(H+)•c(OH-),所以满足:Ka•Kh=Kw,故⑤正确;
故选D.
点评 本题考查较综合,涉及化学平衡、弱电解质的电离、盐类水解、难溶物溶解平衡等知识点,为高频考点,题目难度中等,明确电解质电离特点、难溶物溶解平衡影响因素等知识点是解本题关键,难点是⑤,注意掌握电离平衡常数、水的离子积及水解平衡常数之间关系.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑥ | B. | ②③④ | C. | ①②④ | D. | ①②④⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
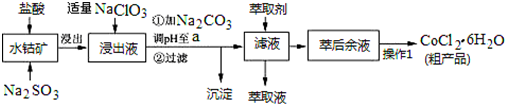
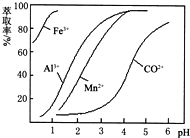
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
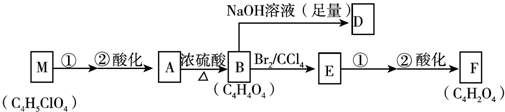
 +(2n-1)H2O.
+(2n-1)H2O. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
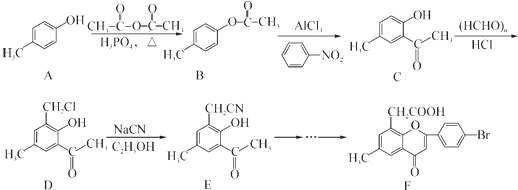
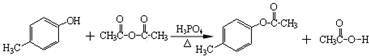 .
.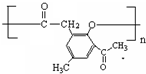 .
.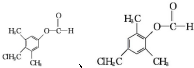 .
.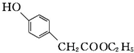 )是一种重要的医药中间体.写出以A和乙醇为主要原料制备对羟基苯乙酸乙酯的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
)是一种重要的医药中间体.写出以A和乙醇为主要原料制备对羟基苯乙酸乙酯的合成路线流程图(无机试剂任选).合成路线流程图示例如下: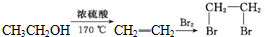
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
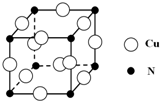 硼和氮元素在化学中有很重要的地位,回答下列问题:
硼和氮元素在化学中有很重要的地位,回答下列问题: .预计于2017年发射的“嫦娥五号”探测器采用的长征5号运载火箭燃料为偏二甲肼[(CH3)2NNH2].(CH3)2NNH2中N原子的杂化方式为sp3.
.预计于2017年发射的“嫦娥五号”探测器采用的长征5号运载火箭燃料为偏二甲肼[(CH3)2NNH2].(CH3)2NNH2中N原子的杂化方式为sp3.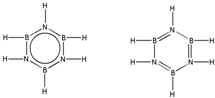 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com