
【题目】甲醇是重要的化工原料。利用合成气(主要成分为(CO,CO2和H2)在催化剂的作用下合成甲醇,可能发生的反应如下:
i:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1
ii:CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH2
CO(g)+H2O(g) ΔH2
iii:CH3OH(g)![]() CO(g)+2H2(g) ΔH3
CO(g)+2H2(g) ΔH3
回答下列问题:
(1)已知反应2中相关化学键键能数据如下:
化学键 | H—H | C=O | C≡O | H—O |
E/KJ·mol-1 | 436 | 803 | 1076 | 465 |
由此计算ΔH2=___kJ·mol-1。已知ΔH1=-63kJ·mol-1,则ΔH3=___kJ·mol-1。
(2)对于反应1,不同温度对CO2的平衡转化率及催化剂的效率影响如图所示,请回答下列问题:
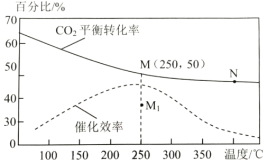
①下列说法不正确的是(__________)
A.M点时平衡常数比N点时平衡常数大
B.温度低于250℃时,随温度升高甲醇的平衡产率降低
C.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于M1
D.实际反应应尽可能在较低的温度下进行,以提高CO2的转化率
②若在刚性容器中充入3molH2和1molCO2发生反应1,起始压强为4MPa,则图中M点CH3OH的体积分数为___,250℃时反应的平衡常数Kp=___(MPa)-2(保留三位有效数字);
③若要进一步提高甲醇产率,可采取的措施有___(写两条即可)
(3)相同条件下,一定比例CO/CO2/H2混合气体甲醇生成速率大于CO2/H2混合气体甲醇生成速率,结合反应1、2分析原因:___。
(4)以二氧化钛表面覆盖Cu2A12O4为催化剂,可以将CO2和CH4直接转化成乙酸,CO2(g)+CH4(g)![]() CH3COOH(g),在不同温度下催化剂的催化效率与乙酸的生成速率如图所示:
CH3COOH(g),在不同温度下催化剂的催化效率与乙酸的生成速率如图所示:
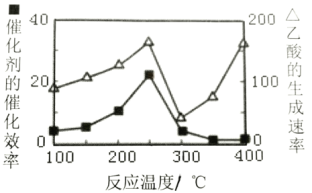
250~300℃时,乙酸的生成速率降低的主要原因是___。
300~400℃时,乙酸的生成速率升高的主要原因是___。
【答案】+36 +99 CD 16.7%或![]() 0.148 增大压强、及时移走生成物、降低温度、增大氢气投料比、换更优催化剂 CO的存在促使反应ⅱ平衡逆向移动;水蒸气的量减少,促使反应ⅰ平衡正向移动 催化剂的催化效率降低 温度升高对反应速率影响为主要因素
0.148 增大压强、及时移走生成物、降低温度、增大氢气投料比、换更优催化剂 CO的存在促使反应ⅱ平衡逆向移动;水蒸气的量减少,促使反应ⅰ平衡正向移动 催化剂的催化效率降低 温度升高对反应速率影响为主要因素
【解析】
(1)根据焓变=反应物键能之和-生成物键能之和,可得CO2(g)+H2(g)CO(g)+H2O(g)△H2;根据盖斯定律可得CH3OH(g)CO(g)+2H2(g)的△H3;
(2) ①反应焓变小于零为放热反应,温度越高平衡常数越小,催化剂可以加快反应的速率,但不影响平衡移动;化工生产时,既要考虑反应速率又要考虑转化率或产率的双重影响,以此来选择化工生产的适宜条件;
②初始投料为3molH2和1molCO2,M点CO2的转化率为50%,恒容容器中气体的体积分数即物质的量分数,则列三段式进行相关计算;恒温恒容条件下,气体的压强之比等于物质的量之比,初始气体的总物质的量为4mol,压强为4MPa,则平衡时气体的总物质的量为3mol,压强为3MPa,据平衡时各物质的分压带入平衡常数计算公式进行计算;
③该反应气体减少的反应,增大压强、及时移走生成物使平衡正向移动;该反应为放热反应,降低温度、增大氢气投料比、换更优催化剂都可以提高甲醇的产率;
(3)CO的存在促使反应ⅱ平衡逆向移动;水蒸气的量减少,促使反应ⅰ平衡正向移动,所以一定比例CO/CO2/H2混合气体甲醇生成速率大于CO2/H2混合气体甲醇生成速率;
(4)250~300℃时,催化剂的催化效率降低,所以乙酸的生成速率降低;300~400℃时,温度升高对反应速率影响为主要因素,所以乙酸的生成速率升高。
(1)根据焓变=反应物键能之和-生成物键能之和,可得CO2(g)+H2(g)CO(g)+H2O(g)△H2=803×2kJ/mol+436kJ/mol-1076kJ/mol-2×465kJ/mol=+36kJ/mol;
已知①CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H1=-63kJmol-1,②CO2(g)+H2(g)CO(g)+H2O(g)△H2=+36kJ/mol根据盖斯定律反应②-反应①得到③CH3OH(g)CO(g)+2H2(g)的△H3=+99kJ/mol;
(2)①A.反应焓变小于零为放热反应,温度越高平衡常数越小,所以M点平衡常数大于N点平衡常数,故A正确;
B.据图可知温度低于250℃时,随温度升高CO2的平衡转化率下降,即平衡逆向移动,所以甲醇的平衡产率降低,故B正确;
C.温度相同平衡常数不变,不改变投料的情况下,即使不使用催化剂,CO2的平衡转化率也位于M点,故C错误;
D.虽然该反应为放热反应,降低温度可以增大CO2的平衡转化率,但温度过低反应速率会很慢,单位时间内CO2的转化率降低,所以不能在较低温度下进行,故D错误;
综上所述答案为CD;
②初始投料为3molH2和1molCO2,M点CO2的转化率为50%,则列三段式有:

恒容容器中气体的体积分数即物质的量分数,所以CH3OH的体积分数为![]() =16.7%或
=16.7%或![]() ;恒温恒容条件下,气体的压强之比等于物质的量之比,初始气体的总物质的量为4mol,压强为4MPa,则平衡时p(CO2)=p(CH3OH) =p(H2O)=0.5MPa,p(H2)=1.5MPa,则Kp=
;恒温恒容条件下,气体的压强之比等于物质的量之比,初始气体的总物质的量为4mol,压强为4MPa,则平衡时p(CO2)=p(CH3OH) =p(H2O)=0.5MPa,p(H2)=1.5MPa,则Kp=![]() =0.148;
=0.148;
③该反应气体减少的反应,增大压强可以使平衡正向移动提高甲醇的产率;及时移走生成物使平衡正向移动也可以增大甲醇的产率;该反应焓变小于零为放热反应,降低温度可以使平衡正向移动从而提高甲醇的产率;增大氢气投料比、换更优催化剂都可以提高甲醇的产率;
(3)CO的存在促使反应ⅱ平衡逆向移动;水蒸气的量减少,促使反应ⅰ平衡正向移动,所以一定比例CO/CO2/H2混合气体甲醇生成速率大于CO2/H2混合气体甲醇生成速率;
(4)250~300℃时,催化剂的催化效率降低,所以乙酸的生成速率降低;300~400℃时,温度升高对反应速率影响为主要因素,所以乙酸的生成速率升高。


科目:高中化学 来源: 题型:
【题目】粗硅提纯常见方法之一是先将粗硅与HCl反应制得SiHCl3,经提纯后再用H2还原:SiHCl3(g)+H2(g) ![]() Si(s)+3HCl(g)。在2L密闭容器中,不同温度及不同n(H2)/n(SiHCl3)时,反应物X的平衡转化率关系如图。下列判断合理的是
Si(s)+3HCl(g)。在2L密闭容器中,不同温度及不同n(H2)/n(SiHCl3)时,反应物X的平衡转化率关系如图。下列判断合理的是
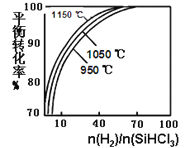
A. X是H2
B. 1150℃反应的平衡常数大于950℃时反应的平衡常数
C. 减小Si(s)的量,有利于提高SiHCl3的转化率
D. 工业上可采用增大压强的方法提高产率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莫沙朵林是一种镇痛药,它的合成路线如下:
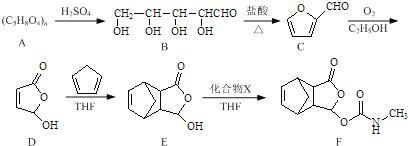
(1)B中手性碳原子数为____________;化合物D中含氧官能团的名称为____________。
(2)C与新制氢氧化铜反应的化学方程式为____________。
(3)写出同时满足下列条件的E的一种同分异构体的结构简式:____________
I.核磁共振氢谱有4个峰;
Ⅱ.能发生银镜反应和水解反应;
Ⅲ.能与FeCl3溶液发生显色反应.
(4)已知E+X→F为加成反应,化合物X的结构简式为____________。
(5)已知:![]() .化合物
.化合物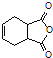 是合成抗病毒药阿昔洛韦的中间体,请设计合理方案以
是合成抗病毒药阿昔洛韦的中间体,请设计合理方案以![]() 和
和![]() 为原料合成该化合物(用合成路线流程图表示,并注明反应条件).______________。
为原料合成该化合物(用合成路线流程图表示,并注明反应条件).______________。
合成路线流程图示例如下:![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z原子序数之和为16,原子半径大小为r(Y)>r(X)>r(Z),它们的常见单质在适当条件下可发生如图变化,其中B和C均为10电子分子。下列说法不正确的是( )

A.X与Z形成的某种化合物可用来杀菌消毒
B.自然界中X单质与Y单质不能发生化学反应
C.B和C分子间因形成氢键而使C极易溶于B中
D.A和C一定条件下能发生氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电催化合成氨法在电能的推动下不受热力学平衡限制,实现N2、H2O常温常压合成氨,如图为N2在不同电极材料表面复化的机制示意图。下列说法正确的是( )
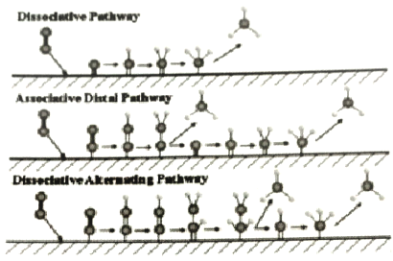
A.电极材料起吸附作用,不影响N2的氢化过程
B.N2在氢化反应之前需先解离成单独的氮原子
C.电催化合成氨原子利用率100%
D.2.8gN2理论上可以产生0.2NA个NH3分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,Y和Z位于同一主族。m、n、p均为由这些元素组成的二元化合物,甲、乙、丙为其中三种元素对应的单质,丙为淡黄色固体,易溶在XZ2中,n是一种二元弱酸。上述物质的转化关系如图所示(反应条件省略)。下列说法正确的是
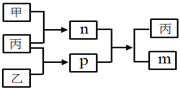
A. 原子半径:W<X<Y B. 非金属性:Y>Z>X
C. Y与Z组成的化合物一定有漂白性 D. W与X组成的化合物中只有极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的化学资源宝库,利用海水可以提取很多物质。
利用1:提溴工业
用海水晒盐之后的盐卤可提取溴,提取流程如图:
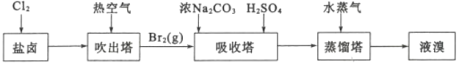
(1)吹出塔中热空气能将溴单质吹出的原因是_____。蒸馏塔中通入水蒸气进行加热,需要控制温度在90℃左右的原因是______。
利用2:提镁工业
从海水提取食盐和Br2之后的盐卤中除含有Mg2+、C1-外,还含有少量Na+、Fe2+、Fe3+、SO42-和CO(NH2)2等,还可以用来提取MgCl2、MgO、Mg(OH)2等物质,流程如图所示:
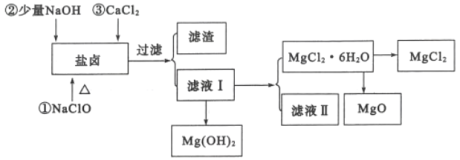
(2)用NaC1O除去尿素CO(NH2)2时,生成物除盐外,还有能参与大气循环的无毒物质,则该反应的化学方程式为_______;加入NaC1O的另一个作用是________。
利用3:淡化工业
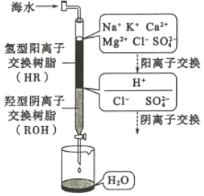
(3)海水淡化的方法主要有闪蒸法、离子交换法、电渗析法等。离子交换法淡化海水模拟过程如图所示。氢型阳离子交换原理可表示为:HR+Na+=NaR+H+;……。羟型阴离子交换树脂填充部分存在的反应有:ROH+C1-=RC1+OH-;______;________。
(4)电渗析法是一种利用离子交换膜进行海水淡化的方法,其原理如图所示:
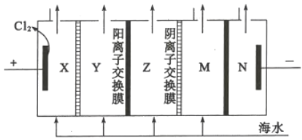
①图中的海水没有直接通入到阴极室中,其原因是_________。
②淡化水在________室(填X、Y、Z、M或N)形成后流出。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
A.氢离子的数目减少
B.溶液中![]() 不变
不变
C.醋酸的电离程度增大,c(H+)亦增大
D.再加入10 mL pH=11的NaOH溶液,混合液pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定CuSO4·xH2O 晶体的x值,数据如表中所示,已知x的理论值为5.0,产生误差的可能原因是( )
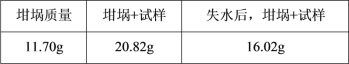
A.晶体中含不挥发杂质B.未做恒重操作
C.加热前晶体未研磨D.加热时有晶体溅出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com