
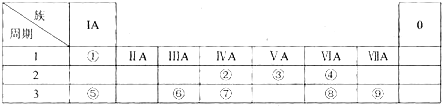

 ,故答案为:
,故答案为: ;
; ,故答案为:
,故答案为: ;
;
| ||
| 冰晶石 |
| ||
| 冰晶石 |


科目:高中化学 来源: 题型:
| A、Na与水反应时,增大水的用量 |
| B、铝与稀硫酸反应时,将铝粉改为铝片 |
| C、在K2SO4与BaCl2两种溶液反应时,增大压强 |
| D、Fe与稀盐酸反应制取氢气时,改用质量分数为36.5%的浓盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)氢是未来最好的能源选择,制取氢气的成熟的方法有很多,利用甲醇可以与水蒸气反应生成氢气,反应方程式如下:
(1)氢是未来最好的能源选择,制取氢气的成熟的方法有很多,利用甲醇可以与水蒸气反应生成氢气,反应方程式如下:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 分别按图中甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计.请回答下列问题:
分别按图中甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O |
| B、Na2O2与H2O反应制备O2:Na2O2+H2O═2Na++2OH-+O2↑ |
| C、将氯气溶于水制备次氯酸:Cl2+H2O═2H++Cl-+ClO- |
| D、用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+═Cu2++2Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com