
分析 根据酸为弱酸时存在电离平衡或利用盐的水解中的水解平衡来说明,并注意弱电解质pH和浓度的关系来分析解答.
解答 解:A、醋酸不易腐蚀衣服,只能说明醋酸为酸,不能说明为弱酸,故A不选;
B、0.1mol/L的CH3COONa溶液的pH约为9,有弱才水解,水解显碱性,则醋酸为弱酸,故B选;
C、等体积等物质的量浓度的H2SO4溶液比等体积等物质的量浓度的CH3COOH溶液消耗的NaOH溶液多,是因硫酸为二元酸,不能说明醋酸为弱酸,故C不选;
D、0.1mol/L的CH3COOH溶液pH约为2.9,说明醋酸电离不完全,存在电离平衡,则说明醋酸为弱酸,故D选;
E、相同体积的pH均等于4的盐酸和CH3COOH溶液,被同一物质的量浓度的NaOH溶液中和,CH3COOH溶液消耗的NaOH溶液多,说明醋酸的浓度大于10-4mol/L,即醋酸为弱酸,故E选;
F、镁粉与一定量稀硫酸反应,如果向其中加入少量醋酸钠可以降低反应速率是因氢离子结合醋酸根离子结合生成弱电解质醋酸,醋酸的电离是不完全的,随反应的进行醋酸在持续电离,则醋酸为弱电解质,故F选;
故选BDEF.
点评 本题考查弱电解质的判断,注意弱电解质是不能完全电离的,一般利用电离平衡和盐的水解平衡来判断弱电解质,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年四川省高二上第一次月考化学卷(解析版) 题型:填空题
A、B、C、D、E、F、G是前四周期(除稀有气体)原子序数依次增大的七种元素,A的原子核外电子只有一种运动状态;B、C的价电子层中未成对电子数都是2;B、C、D同周期;E核外的s、p能级的电子总数相筹;F与E同周期且第一电离能比E小;G的+1价离子(G+)的各层电子全充满。回答下列问题:(相关问题用元素符号表示)
(1)写出E的基态原子的电子排布式________________________。
(2)B与C可形成化合物BC和BC2,BC2属于__________(填“极性”、“非极性”)分子,1 mol BC含有π键为____________________mol。
(3)由元素A、C、G组成的离子[G(A2C)4]2+在水溶液中显天蓝色,不考虑空间结构,[G(A2C)4]2+的结构可用示意图表示为__________(配位键用→标出)。
(4)测定A、D形成的化合物的相对分子质量时,实验测定值一般高于理论值的原因是_______。
(5)由元素A、B、F组成的原子个数比9 : 3 : 1的一种物质,分子中含三个相同的原子团,其结构简式为________________,分子中F原子的杂化方式为__________,该物质遇水爆炸,生成白色沉淀和无色气体,反应的化学方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅是光导纤维的主要成分 | |
| B. | 硅钨酸H4SiW12O40中W的化合价为+6 | |
| C. | 二氧化硅与水反应制得的硅酸溶胶有丁达尔效应 | |
| D. | 硅是非金属元素,合金材料中不可能含有硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
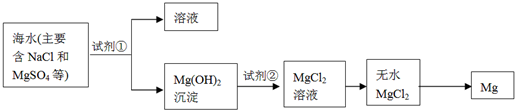
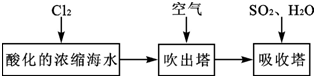
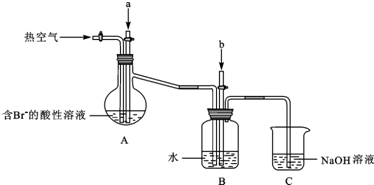
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铂丝蘸取少量某溶液进行焰色反应,透过蓝色钴玻璃观察到火焰呈紫色,该溶液一定是钾盐溶液 | |
| B. | 在0.1mol•L-1Na2CO3溶液中,加两滴酚酞显浅红色,微热后红色加深,说明盐类水解反应是吸热反应 | |
| C. | 向某FeCl2 溶液中加入KSCN溶液,观察到溶液呈血红色,说明该溶液中FeCl2已全部被氧化 | |
| D. | 向某溶液中加入稀盐酸,产生的气体通入澄清石灰水,石灰水变浑浊,该溶液一定含有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5(b-2a) mol/L | B. | 10(2a-b) mol/L | C. | 10(b-a) mol/L | D. | 10(b-2a) mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H2 | B. | C2H4 | C. | C2H6 | D. | C6H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 起始浓度/mol•L-1 | 3 | 1 | 0 |
| 2s末浓度/mol•L-1 | 1.8 | 0.6 | 0.8 |
| A. | 0.4 mol•L-1•s-1 | B. | 0.2 mol•L-1•s-1 | C. | 0.8 mol•L-1•s-1 | D. | 0.6 mol•L-1•s-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com