
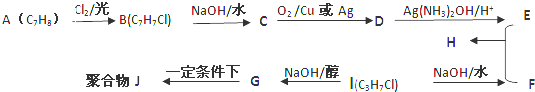
 ��D�Ĺ���������ȩ����
��D�Ĺ���������ȩ���� +O2$��_{��}^{Cu}$2
+O2$��_{��}^{Cu}$2 +2H2O��
+2H2O�� +CH3CH��OH��CH3$��_{��}^{Ũ����}$
+CH3CH��OH��CH3$��_{��}^{Ũ����}$ +H2O��
+H2O��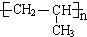 ��
�� ���� A���ڷ�����������ʽΪC7H8����AΪ ��B�������ڹ��������·�������ȡ����Ӧ����B�����B�ķ���ʽ��֪BΪ
��B�������ڹ��������·�������ȡ����Ӧ����B�����B�ķ���ʽ��֪BΪ ��B����ˮ�ⷴӦ����CΪ
��B����ˮ�ⷴӦ����CΪ ��C��������������DΪ
��C��������������DΪ ��D��������Һ��Ӧ���ữ�õ�EΪ
��D��������Һ��Ӧ���ữ�õ�EΪ ��I�ķ���ʽΪC3H7Cl���˴Ź�������Ϊ����壬�ҷ�������Ϊ6��1����IΪCH3CHClCH3��I����ˮ�ⷴӦ�õ�FΪCH3CH��OH��CH3��E��F����������Ӧ����HΪ
��I�ķ���ʽΪC3H7Cl���˴Ź�������Ϊ����壬�ҷ�������Ϊ6��1����IΪCH3CHClCH3��I����ˮ�ⷴӦ�õ�FΪCH3CH��OH��CH3��E��F����������Ӧ����HΪ ��I������ȥ��Ӧ����GΪCH2=CHCH3��G�����Ӿ۷�Ӧ����JΪ
��I������ȥ��Ӧ����GΪCH2=CHCH3��G�����Ӿ۷�Ӧ����JΪ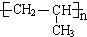 ��
��
��� �⣺A���ڷ�����������ʽΪC7H8����AΪ ��B�������ڹ��������·�������ȡ����Ӧ����B�����B�ķ���ʽ��֪BΪ
��B�������ڹ��������·�������ȡ����Ӧ����B�����B�ķ���ʽ��֪BΪ ��B����ˮ�ⷴӦ����CΪ
��B����ˮ�ⷴӦ����CΪ ��C��������������DΪ
��C��������������DΪ ��D��������Һ��Ӧ���ữ�õ�EΪ
��D��������Һ��Ӧ���ữ�õ�EΪ ��I�ķ���ʽΪC3H7Cl���˴Ź�������Ϊ����壬�ҷ�������Ϊ6��1����IΪCH3CHClCH3��I����ˮ�ⷴӦ�õ�FΪCH3CH��OH��CH3��E��F����������Ӧ����HΪ
��I�ķ���ʽΪC3H7Cl���˴Ź�������Ϊ����壬�ҷ�������Ϊ6��1����IΪCH3CHClCH3��I����ˮ�ⷴӦ�õ�FΪCH3CH��OH��CH3��E��F����������Ӧ����HΪ ��I������ȥ��Ӧ����GΪCH2=CHCH3��G�����Ӿ۷�Ӧ����JΪ
��I������ȥ��Ӧ����GΪCH2=CHCH3��G�����Ӿ۷�Ӧ����JΪ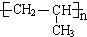 ��
��
��1��B�Ľṹ��ʽΪ ��DΪ
��DΪ �����еĹ���������Ϊȩ����
�����еĹ���������Ϊȩ����
�ʴ�Ϊ�� ��ȩ����
��ȩ����
��2��B��C�ķ�Ӧ����Ϊ��ȡ����Ӧ��ˮ�ⷴӦ�� D��E�ķ�Ӧ����Ϊ������Ӧ��
�ʴ�Ϊ��ȡ����Ӧ��ˮ�ⷴӦ��������Ӧ��
��3����C��D�Ļ�ѧ����ʽ��2 +O2$��_{��}^{Cu}$2
+O2$��_{��}^{Cu}$2 +2H2O��
+2H2O��
��E+F��H�Ļ�ѧ����ʽ�� +CH3CH��OH��CH3$��_{��}^{Ũ����}$
+CH3CH��OH��CH3$��_{��}^{Ũ����}$ +H2O��
+H2O��
��I��G�Ļ�ѧ����ʽ��CH3CHClCH3+NaOH$��_{��}^{��}$CH2=CHCH3��+NaCl+H2O��
��G��J�Ļ�ѧ����ʽ��n CH2=CHCH3$\stackrel{һ������}{��}$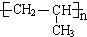 ��
��
�ʴ�Ϊ��2 +O2$��_{��}^{Cu}$2
+O2$��_{��}^{Cu}$2 +2H2O��
+2H2O�� +CH3CH��OH��CH3$��_{��}^{Ũ����}$
+CH3CH��OH��CH3$��_{��}^{Ũ����}$ +H2O��
+H2O��
CH3CHClCH3+NaOH$��_{��}^{��}$CH2=CHCH3��+NaCl+H2O��
n CH2=CHCH3$\stackrel{һ������}{��}$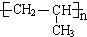 ��
��
���� ���⿼���л����ƶϣ���������л������ʽ�뷴Ӧ���������ƶϣ���Ҫѧ���������չ����ŵ�������ת�����Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
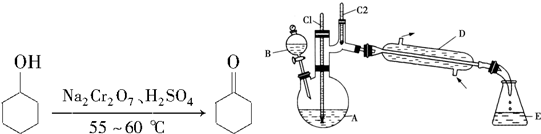
| ���� | �е㣨�棩 | �ܶȣ�g•cm-3��20�棩 | �ܽ��� |
| ������ | 161.1��97.8�� | 0.962 4 | ������ˮ |
| ����ͪ | 155.6��95�� | 0.947 8 | ����ˮ |
| ����ʳ��ˮ | 108.0 | 1.330 1 | |
| ˮ | 100.0 | 0.998 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��֪�Ʊ��״����йػ�ѧ��Ӧ��ƽ�ⳣ�������ʾ��
��֪�Ʊ��״����йػ�ѧ��Ӧ��ƽ�ⳣ�������ʾ��| ��ѧ��Ӧ | ��Ӧ�� | ƽ�ⳣ����850�棩 |
| ��CO2 ��g��+3H2 ��g���TCH3OH��g��+H2O��g�� | ��H1=-48.8 kJ•mol��1 | K1=320 |
| ��CO��g��+H2O��g���TH2��g��+CO2��g�� | ��H2=-41.2 kJ•mol��1 | K2 |
| ��CO��g��+2H2��g���TCH3OH��g���� | ��H3 | K3=160 |
| ���� | H2 | CO2 | CH3OH | H2O |
| Ũ�ȣ�mol•L��1�� | 0.2 | 0.2 | 0.4 | 0.4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
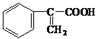 ���ͼ״���Ӧ�Ƶã�
���ͼ״���Ӧ�Ƶã�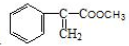
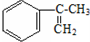 �����IJ���ͬ���͵ķ�Ӧ�Ƶð����ᣮ
�����IJ���ͬ���͵ķ�Ӧ�Ƶð����ᣮ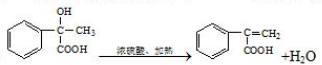 ��
��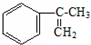 ������̼ԭ�ӵ�һ��ͬϵ���A������̼ԭ�ӿ��Դ���ͬһƽ���ϣ�д��A�Ľṹ��ʽ
������̼ԭ�ӵ�һ��ͬϵ���A������̼ԭ�ӿ��Դ���ͬһƽ���ϣ�д��A�Ľṹ��ʽ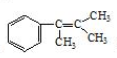 ��
��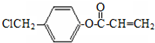 �ǰ����������ij��ͬ���칹���һ�ȴ��������������������Һ���ȣ����ɵ��л�����Ľṹ��ʽΪ
�ǰ����������ij��ͬ���칹���һ�ȴ��������������������Һ���ȣ����ɵ��л�����Ľṹ��ʽΪ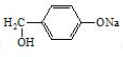 ��
��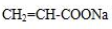 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
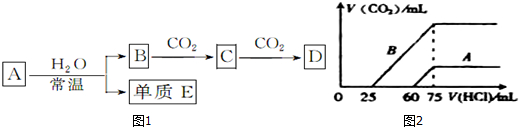
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Һ����ʱ���Ƚ���Һ©���е��²�Һ��ų����ٽ��ϲ�Һ����ŷų� | |
| B�� | ����������ʹNaCl����Һ������ʱ��Ӧ����������NaCl��Һȫ���������� | |
| C�� | ����ʵ�����¶ȼƵ�ˮ����Ӧ����Һ̬������� | |
| D�� | ����ʱ��������ĩ��Ӧ�����������ֽ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Ӧ���ʣ��ң��� | |
| B�� | ƽ��������SO2������������ң��� | |
| C�� | SO2��ת���ʣ��ң��� | |
| D�� | ƽ��ʱO2������������ף��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 10% | B�� | 9.1% | C�� | 1% | D�� | 20% |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com