
【题目】一定温度下,在恒容密闭容器中发生反应NO2(g)+SO2(g) ![]() SO3(g)+NO(g)ΔH= - 41.8 kJmol-1,下列能说明该反应达到平衡状态的是
SO3(g)+NO(g)ΔH= - 41.8 kJmol-1,下列能说明该反应达到平衡状态的是
A.ΔH的数值不再变化B.容器内的压强不再变化
C.气体的颜色不再变化D.气体的密度保持不变
科目:高中化学 来源: 题型:
【题目】某种待测浓度的H2SO4溶液20 mL,加入10 mL 0.5 mol/L BaCl2溶液,恰好完全反应。
(1)得到BaSO4沉淀多少克?____________
(2)待测H2SO4溶液的物质的量浓度是多少?______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是由常见元素组成的一些单质及其化合物之间的转化关系图。各方框中的字母表示一种反应物或生成物(部分物质,反应条件已经略去)。其中A、B、D在常温下均为无色无味的气体,C是能使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体。
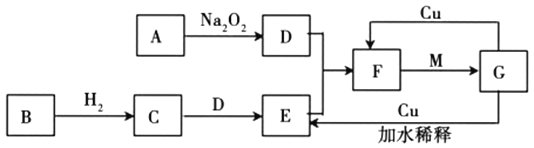
(1)写出![]() 的化学方程式:_______________________。
的化学方程式:_______________________。
(2)实验室常用加热两种固体混合物的方法制备物质C,其化学方程式为_________,干燥C常用_______________(填写试剂名称)。
(3)E物质遇到D物质时,会观察到_______________________现象,若用排水法收集F,则最终集气瓶中收集到的气体为____________________(写化学式)。
(4)写出![]() 的离子反应方程式_________________________。
的离子反应方程式_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对各电解质溶液的分析正确的是( )
A.硫酸铁溶液中能大量共存的离子:K+、Na+、NO3-、CO32-
B.Ca(HCO3)2溶液与过量NaOH溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O
C.0.1molL﹣1Na2S溶液中存在:c(OH-)=c(H+)+c(HS﹣)+2c(H2S)
D.NH4HSO4溶液呈酸性的主要原因是:NH4++H2O![]() NH3H2O+H+
NH3H2O+H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质(均为中学化学常见物质)转化关系图中,D为红棕色粉末(反应条件及部分反应物、产物未全部说明),B、C、E为常见单质,A、D为氧化物。
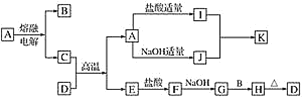
根据图示转化关系填写下列空白:
(1)写出下列物质的化学式A________,B________,G________。
(2)C与D的混合物通常称__________(填名称)。
(3)写出下列化学方程式或离子方程式
①I+J→K________________(离子方程式)。
②G+B→H________________(化学方程式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将4molA(g)和2molB(g)充入2L恒容密闭容器中,发生2A(g)+B(g) ![]() 2C(g),一段时间达到平衡,反应过程中测定的数据如下表。下列说法正确的是
2C(g),一段时间达到平衡,反应过程中测定的数据如下表。下列说法正确的是
t/min | 2 | 4 | 8 | 9 |
n(B)/mol | 1.5 | 1.2 | 1.0 | 1.0 |
A.该温度下反应的平衡常数K=1.0
B.反应0~4 min的平均速率υ(C)=0.4 molL﹣1min﹣1
C.其他条件不变,升高温度反应的平衡常数增大,则该反应为吸热反应
D.其他条件不变,再充入4molA(g),达到新平衡时A的浓度减小,B的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.将FeCl3溶液和Fe2(SO4)3溶液分别加热、蒸干、灼烧,所得固体成分相同
B.水解反应NH4++H2O![]() NH3H2O+H+达到平衡后,升高温度平衡逆向移动
NH3H2O+H+达到平衡后,升高温度平衡逆向移动
C.CH3COONa溶液中加入CH3COOH能促进CH3COO-水解
D.常温下,浓度均为0.1molL-1 NaCN和HCN混合液的pH=9,则c(HCN)>c(Na+)>c(CN﹣)>c(OH﹣)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.4g NaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
A. B.
B.
C. D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列各题:
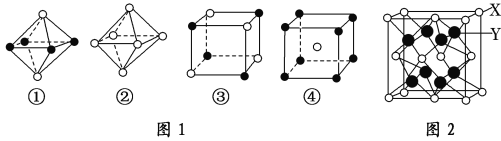
(1)已知FeCl3的沸点:319℃,熔点:306℃,则FeCl3的晶体类型为___________。P形成的三种酸的酸性由强到弱的顺序为:HPO3>H3PO4>H3PO3,原因是___________________。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2,T的基态原子价电子排布式为___________________,Q2+的未成对电子数是______________。
(3)如图1是从NaCl或CsCl晶体结构图中分割出来的部分结构图,判断NaCl晶体结构的图是图1中的______________。
(4)[Cu(NH3)4]2+配离子中存在的化学键类型有_____________(填序号)。
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
(5)若[Cu(NH3)4]2+具有对称的空间构型,且当[Cu(NH3)4]2+中的两个NH3被两个Cl-取代时,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为______________(填序号)
①平面正方形 ②正四面体 ③三角锥形 ④V形
(6)X与Y可形成离子化合物,其晶胞结构如图2所示,其中X和Y的相对原子质量分别为a和b,NA表示阿伏加德罗常数,晶体密度为ρg/cm3,则晶胞中距离最近的X、Y之间的核间距离是_____________pm(用含ρ、a、b、NA的代数式表达)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com