
| A. | CH3CH2CH2Cl | B. | CH3CHBrCH(CH3)CH2Br | ||
| C. | CH3CHBrCH2CH2Br | D. | CH3CH2Br |
分析 根据题目信息:2CH3CH2Br+2Na→CH3CH2CH2CH3+2NaBr,可知反应的原理为:碳溴键发生断裂,溴原子与钠形成氯化钠,与氯原子相连的碳相连形成新的碳碳键,若形成环状结构,分子中一定含有两个溴原子,据此完成解答.
解答 解:A.CH3CH2CH2Br与钠以2:2发生反应生成CH3CH2CH2CH2CH2CH3,故A错误;
B.CH3CHBrCH(CH3)CH2Br与钠反应生成环状化合物,故B正确;
C.CH3CHBrCH2CH2Br与钠以1:2发生反应生成甲基环丙烷,与环丙烷属于同系物,故C正确;
D.CH3CH2Br与钠以1:2发生反应生成CH3CH2CH2CH3,故D错误;故选:BC.
点评 本题考查了卤代烃的反应,本题是以题给信息为背景,考查了学生获取信息、分析问题和解决问题的能力,题目难度不大.


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某物质的溶液中由水电离出的c(H+)=1×10-amol/L,若a>7时,则该溶液的pH一定为14-a | |
| B. | CH3COONa溶液与HCl溶液混合所得的中性溶液中:c(Na+)>c(Cl-) | |
| C. | Na2S和NaHS的混合溶液中:c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-) | |
| D. | pH=8的NaHCO3溶液中:c(HCO3-)>c(CO32-)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

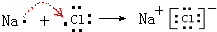 、
、 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使高分子材料具有仿生能力 | |
| B. | 使高分子材料向功能材料方向发展 | |
| C. | 使高分子材料越来越牢固,难分解 | |
| D. | 使农用薄膜能够选择性地透过某种植物所需要的特定波长的光 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
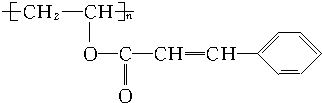
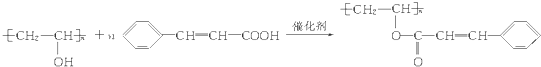 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知25℃时部分弱电解质的电离平衡常数数据如表所示:
已知25℃时部分弱电解质的电离平衡常数数据如表所示:| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BOH的电离方程式是BOH═B++OH- | |
| B. | 将一定体积的上述两种溶液混合后得到中性溶液,则V(HA)<V(BOH) | |
| C. | 在0.1 mol•L-1BA溶液中,c(B+)>c(A-)>c(OH-)>c(H+) | |
| D. | 若将0.1 mol•L-1BOH溶液稀释至0.001 mol•L-1,则溶液的pH=9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com