
科目:高中化学 来源: 题型:选择题
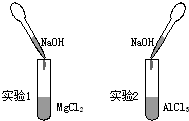
| A. | 加入铝片立即放出氢气的溶液中:C1-、K+、NH4+、NO3- | |
| B. | 滴加石蕊试液呈红色的溶液中:CO32-、K+、ClO-、OH- | |
| C. | pH=13的溶液中:HCO3-、Na+、NO3-、SO42 | |
| D. | 在pH=3的溶液中:NH4+、Ca2+、C1-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)已知反应:H2+Cl2$→_{400℃}^{CuO/CuCl_{2}}$2HCl,已知H-H键能为436kJ/mol,Cl-Cl键能为243kJ/mol,H-Cl键能为432kJ/mol.
(1)已知反应:H2+Cl2$→_{400℃}^{CuO/CuCl_{2}}$2HCl,已知H-H键能为436kJ/mol,Cl-Cl键能为243kJ/mol,H-Cl键能为432kJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20% | B. | 23.7% | C. | 25% | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
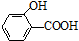 )存在分子内氢键,对羟基苯甲酸 (
)存在分子内氢键,对羟基苯甲酸 ( 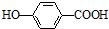 )存在分子间氢键.则两者的熔点、沸点的相对大小关系是( )
)存在分子间氢键.则两者的熔点、沸点的相对大小关系是( )| A. | 前者>后者 | B. | 前者<后者 | C. | 前者=后者 | D. | 无法估计 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
; +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$ +3H2O;
+3H2O;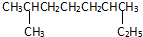 的系统命名是:2,6-二甲基辛烷;
的系统命名是:2,6-二甲基辛烷;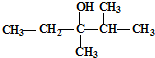 的键线式是
的键线式是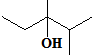 ;
;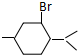 的分子中含有3个手性碳原子;
的分子中含有3个手性碳原子; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com