
| A | B | ||
| D | E | G | J |
| L | M | Q |
 .写出一个能表示元素G、J非金属性强弱关系的化学方程式H2S+Cl2=2HCl+S↓或Na2S+Cl2=2NaCl+S↓.
.写出一个能表示元素G、J非金属性强弱关系的化学方程式H2S+Cl2=2HCl+S↓或Na2S+Cl2=2NaCl+S↓.分析 A、B、D、E、G、J为短周期元素,G元素的核电荷数为B元素的2倍,G为第三周期元素,结合位置可知B、G同主族,则B为O,G为S,A为N,D为Si,E为P,J为Cl,L为Ge,M为As,Q为Se,
(1)J的最高价为+7价;
(2)G2J2中存在Cl-S、S-S键,利用单质之间的置换反应比较非金属性;
(3)氯酸钾分解可制备氧气,由信息可知,二氧化硫与氯酸反应生成硫酸和二氧化氯;
(4)A的氢化物为氨气,铵盐与碱加热可制备氨气;
(5)位于金属与非金属交界处的元素单质具有半导体特性.
解答 解:A、B、D、E、G、J为短周期元素,G元素的核电荷数为B元素的2倍,G为第三周期元素,结合位置可知B、G同主族,则B为O,G为S,A为N,D为Si,E为P,J为Cl,L为Ge,M为As,Q为Se,
(1)J的最高价为+7价,最高价氧化物对应水化物的化学式是HClO4,故答案为:HClO4;
(2)G2J2中存在Cl-S、S-S键,其电子式为 ,表示元素G、J非金属性强弱关系的化学方程式如H2S+Cl2=2HCl+S↓或 Na2S+Cl2=2NaCl+S↓,
,表示元素G、J非金属性强弱关系的化学方程式如H2S+Cl2=2HCl+S↓或 Na2S+Cl2=2NaCl+S↓,
故答案为: ;H2S+Cl2=2HCl+S↓或 Na2S+Cl2=2NaCl+S↓;
;H2S+Cl2=2HCl+S↓或 Na2S+Cl2=2NaCl+S↓;
(3)氯酸钾分解可制备氧气,由信息可知,二氧化硫与氯酸反应生成硫酸和二氧化氯,反应为SO2+2HClO3$\frac{\underline{\;一定条件\;}}{\;}$H2SO4+2ClO2,1molJ的含氧酸反应有NA个电子转移,
故答案为:SO2+2HClO3$\frac{\underline{\;一定条件\;}}{\;}$H2SO4+2ClO2;
(4)A的氢化物为氨气,为极性分子,铵盐与碱加热可制备氨气,制备反应为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O 或 NH3•H2O$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,
故答案为:极性;2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O 或 NH3•H2O$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O;
(5)位于金属与非金属交界处的元素单质具有半导体特性,则长周期中Ge、As的单质具有半导体特性,故答案为:Ge、As.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、性质、元素周期律、元素化合物等为解答的关键,侧重分析与应用能力的考查,注意化学用语的使用,题目难度不大.


 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案科目:高中化学 来源: 题型:实验题
 某红色固体粉末样品可能含有Fe2O3和Cu2O中的一种或两种,某化学兴趣小组对其组成进行探究.完成下列空格.
某红色固体粉末样品可能含有Fe2O3和Cu2O中的一种或两种,某化学兴趣小组对其组成进行探究.完成下列空格.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 都能作干燥剂 | B. | 都具有一定的氧化性 | ||
| C. | 加热时都能与铜发生反应 | D. | 在常温下都能用铁制容器贮存 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
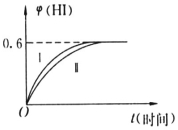 将1molI2(g)和2molH2(g)置于某2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)?2HI(g)△H<0,并在10min时达到平衡.HI的体积分数φ(HI)随时间变化如图所示曲线(Ⅱ).
将1molI2(g)和2molH2(g)置于某2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)?2HI(g)△H<0,并在10min时达到平衡.HI的体积分数φ(HI)随时间变化如图所示曲线(Ⅱ).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,4.48 L重水(D2O)中含有的中子数为2NA | |
| B. | 0.1mol乙烯和乙醇(C2H5OH,蒸汽)混合物完全燃烧所消耗的氧分子数一定为0.3NA | |
| C. | 常温常压下,15g乙烷分子中含有的共价键数目为3NA | |
| D. | 273K,101kPa下,14g乙烯与丙烯混合物中含有碳原子数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
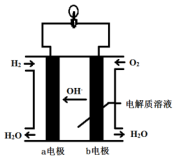 英国一家公司正在研发全球首款“充一次电,用七天”的碱性氢氧燃料手机电池.如图为碱性氢氧燃料电池结构示意图.
英国一家公司正在研发全球首款“充一次电,用七天”的碱性氢氧燃料手机电池.如图为碱性氢氧燃料电池结构示意图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Cl-、PO43-、Na+ | B. | H+、Fe2+、SO42-、NO${\;}_{3}^{-}$ | ||
| C. | K+、H+、NO${\;}_{3}^{-}$、Na+ | D. | OH-、Br-、SO42-、NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁表面镀锌可增强其抗腐蚀性 | |
| B. | 二氧化硅是将太阳能转变为电能的常用材料 | |
| C. | 可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气 | |
| D. | 酒精能使蛋白质变性,可用于杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
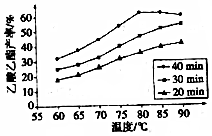 有机酸种类繁多,广泛分布于中草葯的叶、根、特别是果实中,是有机合成、工农业生产的重要原料,请回答下列有关问题:
有机酸种类繁多,广泛分布于中草葯的叶、根、特别是果实中,是有机合成、工农业生产的重要原料,请回答下列有关问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com