
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | CO(OH)2 | Al(OH)3 |
| 开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
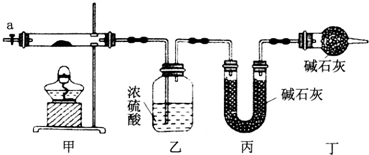
分析 (1)按如图所示装置组装好仪器,应首先检验装置的气密性,加热甲中玻璃管,当乙装置中不再有气泡产生,即碱式碳酸钴分解完毕,步骤中缓缓通入空气数分钟,将装置中生成的CO2和H2O全部排入乙、丙装置中,以免影响测量结果;
(2)空气中的水蒸气和二氧化碳被乙丙装置吸收产生误差,在活塞a前,加装装置干燥管,装置中盛放的碱石灰用来吸收空气中的水蒸气和二氧化碳;
(3)碱式碳酸钴样品3.65g,故生成水的质量为0.36g,物质的量为 $\frac{0.36g}{18g/mol}$=0.02mol,生成二氧化碳的质量为0.88g,物质的量为 $\frac{0.88g}{44g/mol}$=0.02mol,故氧化钴的质量为3.65g-0.36g-0.88g=2.41g,物质的量为 $\frac{2.41g}{75g/mol}$=0.03mol,根据Co、H、C元素守恒计算xyz的比值得到化学式;
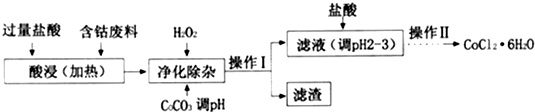
(4)含钴废料(含少量Fe、Al等杂质)制取CoCl2•6H2O,加入过量盐酸酸浸加热,加入过氧化氢氧化亚铁离子为铁离子,加入碳酸钙调节溶液PH使铁离子、铝离子全部沉淀,过滤得到滤液中加入盐酸防止氯化钴水解,通过蒸发浓缩,冷却结晶过滤洗涤干燥等操作得到CoCl2•6H2O;
①三价铁离子易转化为沉淀,所以要把二价铁离子氧化为三价铁离子;
②调节溶液的pH值,使溶液中铁离子和铝离子生成沉淀,而钴离子存在溶液中,从而将铁离子、铝离子和钴离子分开;
③加盐酸调整pH为2~3的目的是抑制氯化钴的水解.
解答 解:(1)按如图所示装置组装好仪器,应首先检验装置的气密性,加热甲中玻璃管,当乙装置中不再有气泡产生,即碱式碳酸钴分解完毕,步骤中缓缓通入空气数分钟,将装置中生成的CO2和H2O全部排入乙、丙装置中,以免影响测量结果,
故答案为:检验装置的气密性,不再有气泡产生,将装置中生成的CO2和H2O全部排入乙、丙装置中;
(2)空气中的水蒸气和二氧化碳被乙丙装置吸收产生误差,在活塞a前,加装装置干燥管,装置中盛放的碱石灰用来吸收空气中的水蒸气和二氧化碳;
故答案为:未考虑空气中的水蒸气和二氧化碳对实验的影响;
(3)碱式碳酸钴样品3.65g,故生成水的质量为0.36g,物质的量为 $\frac{0.36g}{18g/mol}$=0.02mol,生成二氧化碳的质量为0.88g,物质的量为 $\frac{0.88g}{44g/mol}$=0.02mol,故氧化钴的质量为3.65g-0.36g-0.88g=2.41g,物质的量为 $\frac{2.41g}{75g/mol}$=0.03mol,根据Co、H、C元素守恒可知,x:y:z=0.03mol:0.02mol×2:0.02mol=3:4:2,故碱式碳酸钴的化学式为Co3(OH)4(CO3)2,
故答案为:Co3(OH)4(CO3)2;
(4)①三价铁离子易转化为沉淀,所以要加入氧化剂过氧化氢把二价铁离子氧化为三价铁离子,而不会引入新的杂质,反应的离子方程式为;2Fe2++H2O2+2H+=2Fe3++2H2O;
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
②废料加入盐酸后生成氯化物,然后加入双氧水,二价铁离子被双氧水氧化生成三价铁离子,根据沉淀的pH值表格知,当溶液的pH值为5.2时,铁离子和铝离子被完全沉淀,当溶液的pH值为7.6时,钴离子才开始产生沉淀,所以要想将铁离子、铝离子和钴离子分离,溶液的pH值应该不小于5.2不大于7.6,则操作I获得的滤渣成分为Fe(OH)3和Al(OH)3;
故答案为:Fe(OH)3和Al(OH)3;
③加盐酸调整pH为2~3的目的为抑制CoCl2的水解,故答案为:抑制CoCl2的水解.
点评 本题考查学生对实验原理理解、方案设计的评价、实验装置的理解、物质组成的测定等,难度中等,理解实验原理是解题的关键,是对知识的综合运用,需要学生具有扎实的基础与综合运用分析解决问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | 0.05mol•L-1的H2SO4 | B. | 0.1mol•L-1的KNO3 | ||
| C. | 0.1mol•L-1的KOH | D. | 0.1mol•L-1的NH4NO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由溴丙烷水解制丙醇;由丙烯与水反应制丙醇 | |
| B. | 由苯硝化制硝基苯;由乙醇氧化制乙醛 | |
| C. | 由乙酸和乙醇制乙酸乙酯;由乙酸乙酯水解制乙醇 | |
| D. | 由氯代乙烷制乙烯;由丙烯制1,2-二溴丙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 篮烷的结构如图所示:
篮烷的结构如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有机物CH2Cl-CH2Cl用系统命名法命名为:二氯乙烷 | |
| B. | 1mol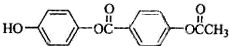 与足量的NaOH溶液充分反应,消耗NaOH的物质的量为3mol 与足量的NaOH溶液充分反应,消耗NaOH的物质的量为3mol | |
| C. | 标准状况下,22.4L己烷所含分子数为NA | |
| D. | 乙醇与乙酸发生酯化反应时,乙醇分子中的碳氧键没断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | B | ||||||
| 2 | D | E | F | G | ||||
| 3 | C | H | I |
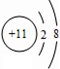 ,I的原子结构示意图
,I的原子结构示意图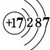 .
.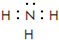 ;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).
;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表是按照元素相对原子质量大小排列而成的 | |
| B. | 元素周期表有7个横行,也是7个周期;有18个纵行,即18个族 | |
| C. | 凡是位于元素周期表中同一周期的元素,都是按从左到右的顺序原子最外层电子数由1递增到8 | |
| D. | 凡是位于元素周期表中同一主族的元素,都是按从上到下的顺序电子层数逐渐增多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4L N2的物质的量为1mol | |
| B. | 标准状况下,1mol任何物质的体积为22.4L | |
| C. | SO2的摩尔质量与相对分子质量相等 | |
| D. | 在相同温度、压强下,相同体积的任何气体分子数相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com