
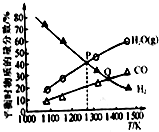
 反应MoS2(s)+2Na2CO3(s)+4H2(g)?Mo(s)+2CO(g)+4H2O(g)+2Na2S(s),可用于由辉钼精矿制取钼,在2L的密闭容器中:加入0.1mol MoS2、0.2mol Na2CO3和0.4mol H2(固体体积忽略不计),测得在不同温度达到平衡时各气体的物质的量分数关系如图所示.下列说法正确的是( )
反应MoS2(s)+2Na2CO3(s)+4H2(g)?Mo(s)+2CO(g)+4H2O(g)+2Na2S(s),可用于由辉钼精矿制取钼,在2L的密闭容器中:加入0.1mol MoS2、0.2mol Na2CO3和0.4mol H2(固体体积忽略不计),测得在不同温度达到平衡时各气体的物质的量分数关系如图所示.下列说法正确的是( )| A. | 容器内的总压:P点<Q点 | |
| B. | 正反应速率:v(Q)<v(P) | |
| C. | P点对应温度时,H2的平衡转化率为40% | |
| D. | P点对应温度的平衡常数的值为2.5×10-3 |
分析 根据图象,P点与Q点,对于氢气,Q点相当于升高温度,氢气的体积分数减小,故正反应为吸热反应,Q点比P点生成物的比例大,正反应速率大于P点,故产生的气体多,压强大,根据三步法计算,设MoS2变化的物质的量为x,
MoS2(s)+2Na2CO3(s)+4H2(g)?Mo(s)+2CO(g)+4H2O(g)+2Na2S(s),
0.1 0.2 0.4 0 0 0 0
x 2x 4x x 2x 4x 2x
0.1-x 0.2-2x 0.4-4x x 2x 4x 2x
P点时氢气的物质的量分数为40%,故$\frac{0.4-4x}{0.4-4x+2x+4x}$×100%=40%,x=0.05;H2的平衡转化率=$\frac{4x}{0.4}×100%$=0.05×100%=50%;P点的平衡常数K=$\frac{{c}^{2}(CO)•{c}^{4}({H}_{2}O)}{{c}^{4}({H}_{2})}$=${\frac{(\frac{0.1}{2})^{2}×(\frac{0.2}{2})^{4}}{(\frac{0.2}{2})^{4}}}^{\;}$=2.5×10-3.
解答 解:A、根据图象,P点与Q点,对于氢气,Q点相当于升高温度,氢气的体积分数减小,故正反应为吸热反应,Q点比P点生成物的比例大,正反应速率大于P点,故产生的气体多,压强大,故容器内的总压:P点<Q点,故A正确;
B、对于氢气,Q点相当于升高温度,反应正向进行,故正反应为吸热反应,正反应速率大于P点,v(Q)>v(P),故B错误;
C、根据三步法计算,设MoS2变化的物质的量为x,
MoS2(s)+2Na2CO3(s)+4H2(g)?Mo(s)+2CO(g)+4H2O(g)+2Na2S(s),
0.1 0.2 0.4 0 0 0 0
x 2x 4x x 2x 4x 2x
0.1-x 0.2-2x 0.4-4x x 2x 4x 2x
P点时氢气的物质的量分数为40%,故$\frac{0.4-4x}{0.4-4x+2x+4x}$×100%=40%,x=0.05;H2的平衡转化率=$\frac{4x}{0.4}×100%$=0.05×100%=50%,故C错误;
D、根据C的解答过程,P点的平衡常数K=$\frac{{c}^{2}(CO)•{c}^{4}({H}_{2}O)}{{c}^{4}({H}_{2})}$=${\frac{(\frac{0.1}{2})^{2}×(\frac{0.2}{2})^{4}}{(\frac{0.2}{2})^{4}}}^{\;}$=2.5×10-3,故D正确;
故选AD.
点评 本题考查平衡移动原理、平衡常数的计算等,难度中等,注意判断曲线表示哪一物质是关键,侧重考查学生对图象的分析与平衡移动的理解,难度较大.


科目:高中化学 来源: 题型:选择题
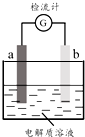 30℃时,利用图装置进行实验,结果记录如下表所示:
30℃时,利用图装置进行实验,结果记录如下表所示:| 实验 | a电极 | b电极 | 电解质溶液 | 现象 |
| I | Cu | Zn | 稀H2SO4 | 检流计指针向左偏转 |
| Ⅱ | Fe | Al | 稀H2SO4 | 检流计指针向左偏转 |
| Ⅲ | Fe | Al | 浓H2SO4 | 检流计指针先向左偏转,后逐渐归零,a电极表面逐渐变黑,b电极表面逐渐变白 |
| Ⅳ | Fe | Al | 浓HNO3 | 检流计指针迅速向右偏转,a电极逐渐溶解,b电极表面逐渐变白 |
| A. | Ⅱ中Al为负极,其电极反应是:Al-3e-═Al3+ | |
| B. | Ⅱ中的现象说明Fe和Al表面形成致密的氧化膜,阻止了电极反应的进行 | |
| C. | Ⅳ中Fe为负极,发生了氧化反应 | |
| D. | 上述实验表明:相同条件下,Fe在浓HNO3中更稳定,Al在浓H2SO4中更稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当滴入20mL NaOH溶液时:c(SO42-)=c(NH3•H2O)+c(NH4+) | |
| B. | 当溶液呈中性时:c(NH4+)>c(SO42-)>c(Na+)>c(H+)=c(OH-) | |
| C. | 整个反应过程中:c(H+)+c(Na+)+c(NH4+)=c(OH-)+c(SO42-) | |
| D. | 当滴入30mL NaOH溶液时,所得溶液pH>7:c(NH3•H2O)>c(NH4+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
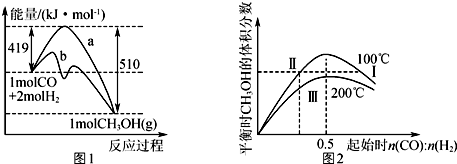
| A. | 正反应的△H=91 kJ•mol-1,曲线b表示使用了催化剂 | |
| B. | 正反应速率v正:v正(状态Ⅱ)<v正(状态Ⅲ) | |
| C. | 平衡时CO的转化率:α(CO,状态Ⅰ)<α(CO,状态Ⅱ) | |
| D. | n(CO):n(H2)=0.5时,平衡时CH3OH的物质的量浓度:c(CH3OH,1 00℃)<c(CH3OH,200℃) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使甲基橙变红色的溶液中:Ca2+、Mg2+、HCO3-、Cl- | |
| B. | 使KSCN变红色的溶液中:NH4+、S2-、Br-、I- | |
| C. | c(H+)/c(OH-)=1012 的溶液中:Cu2+、Al3+、NO3-、SO42- | |
| D. | 由水电离产生的c(H+)•c(OH-)=10-8的溶液中:Na+、K+、AlO2-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
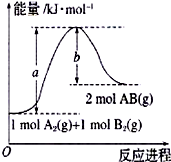 (1)已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,该反应的热化学方程式为A2(g)+B2(g)=2AB(g)△H=(a-b)kJ/mol.
(1)已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,该反应的热化学方程式为A2(g)+B2(g)=2AB(g)△H=(a-b)kJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 混合溶液/实验 | A | B | C | D | E | F |
| 4mol•L-1H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同周期元素的原子半径以 VIIA 族的为最大 | |
| B. | 在周期表中零族元素的单质全部是气体 | |
| C. | IA、IIA 族元素的原子,其半径越大就越容易得电子 | |
| D. | 所有主族元素的最高正价数都和它的族序数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com