
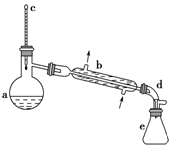
 醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图:
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图: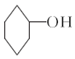 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$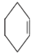 +H2O,
+H2O,| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.961 8 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.810 2 | 83 | 难溶于水 |
 ,生成该物质的反应类型是取代反应
,生成该物质的反应类型是取代反应分析 (1)根据仪器构造可知;
(2)加热过程中,环己醇除可发生消去反应生成环己烯外,还可以发生取代反应生成二环己醚;
(3)由于分液漏斗有活塞开关,故使用前需要检查是否漏液;分液过程中,由于环己烯的密度比水的密度小,故应该从分液漏斗的上口倒出;
(4)在环己烯粗产物蒸馏过程中,根据各仪器的作用选取仪器;
(5)环己醇为0.2mol,理论上可以得到0.2mol环己烯,其质量为16.4g,根据产率=$\frac{实际产量}{理论产量}$×100%计算.
解答 解:(1)依据装置图分析可知装置b是蒸馏装置中的冷凝器装置是直形冷凝管;
故答案为:直形冷凝管(或冷凝管);
(2)加热过程中,环己醇除可发生消去反应生成环己烯外,还可以发生取代反应,分子间发生脱水反应生成二环己醚,副产物的结构简式为 ;
;
故答案为: ;取代反应;
;取代反应;
(3)由于分液漏斗有活塞开关,故使用前需要检查是否漏液;分液过程中,由于环己烯的密度比水的密度小,故应该从分液漏斗的上口倒出;
故答案为:检漏;上口倒出;
(4)观察题目提供的实验装置图知蒸馏过程中不可能用到分液漏斗和蒸发皿;
故答案为:CE;
(5)环己醇的物质的量=$\frac{20g}{100g/mol}$=0.2mol,根据C原子守恒知,理论上生成环己烯的物质的量也是0.2mol,其质量=0.2mol×82g/mol=16.4g,生成的本实验所得到的环己烯产率=$\frac{12}{16.4}$=73.2%;
故答案为:73.2%.
点评 本题考查制备实验方案设计,为高频考点,明确实验原理及实验操作顺序是解本题关键,注意从实验安全性、评价性、操作规范性等方面分析解答,充分利用题给信息解答问题,题目难度中等.


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:推断题
| A | C | |
| B |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若aX2+和bY-的核外电子层结构相同,则原子序数:a=b+3 | |
| B. | 由水溶液的酸性:HC1>HF,可推断出元素的非金属性:C1>F | |
| C. | 锗与硅位于金属与非金属的交界处,都能做半导体材料 | |
| D. | S和Se分别位于第VIA的第三、四周期,则氢化物稳定性:H2S>H2Se |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-55.6 kJ•mol-1 | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-55.6 kJ•mol-1 | |
| C. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-889.6 kJ•mol-1 | |
| D. | CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-889.6kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌为正极,Ag2O为负极 | |
| B. | 锌为负极,Ag2O为正极 | |
| C. | 原电池工作时,溶液中OH- 移向正极 | |
| D. | 原电池工作时,溶液中电子由负极流向正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||
| 4 | ⑧ | ⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2016年10月11日,神舟十一号飞船搭乘CZ-2F火箭成功发射.在重达495 吨的起飞重量中,95%的都是化学推进剂.
2016年10月11日,神舟十一号飞船搭乘CZ-2F火箭成功发射.在重达495 吨的起飞重量中,95%的都是化学推进剂.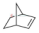 (C7H10)是一种重要的高密度液体燃料化学推进剂.已知:
(C7H10)是一种重要的高密度液体燃料化学推进剂.已知:| 燃料 | 密度(g•cm-3) | 体积热值(J•L-1) |
| 降冰片烯 | 1.0 | 4.2×107 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com