
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaSO3与H2O2的反应为氧化还原反应 | |
| B. | 因为SO2有漂白性,所以SO2可使溴水褪色 | |
| C. | 50 mL 18.4 mol•L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA | |
| D. | Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 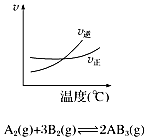 如图说明此反应的正反应是吸热反应 | |
| B. | 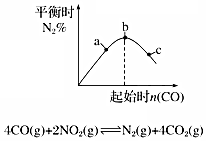 如图说明NO2的转化率b>a>c | |
| C. |  如图说明反应至15 min时,改变的条件是升高温度 | |
| D. |  如图说明生成物D一定是气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体中NO2、NO和O2的物质的量之比为2:2:1 | |
| B. | 单位时间内生成2nmolNO同时生成2nmolNO2 | |
| C. | 单位时间内生成2nmolNO同时生成nmolO2 | |
| D. | 混合气体的颜色变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应时间/min | n(MgSO4)/mol | n(CO)/mol | n(SO2)/mol |
| 0 | 2.0 | 2.0 | 0 |
| 2 | 0.8 | ||
| 4 | 1.2 | ||
| 6 | 1.2 | 2.8 |
| A. | 0~2 min内的平均速率为υ (CO)=0.6 mol/(L•min) | |
| B. | 其他条件不变,若起始时容器中MgSO4、CO均为1.0 mol,则平衡时n(SO2)=0.6 mol | |
| C. | 4 min后,若升高温度,SO2物质的量浓度变为0.7mol/L,则正反应为放热反应 | |
| D. | 4 min后,平衡移动的原因可能是向容器中加入了2.0 mol的SO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com