
分析 根据n=$\frac{V}{{V}_{m}}$计算出标准状况下4.48LCO的物质的量,然后根据反应方程式计算出生成二氧化碳的物质的量,最后根据N=nNA计算出生成的二氧化碳分子个数.
解答 解:标准状况下4.48L CO的物质的量为:$\frac{4.48L}{22.4L/mol}$=0.1mol,根据反应2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2可知,0.1molCO完全反应生成二氧化碳的物质的量为0.1mol,
所以生成的二氧化碳分子个数为:N(CO2)=nNA=0.1NA,
答:生成的二氧化碳分子个数为0.1NA.
点评 本题考查了物质的量的计算、化学方程式的计算,题目难度不大,明确物质的量与气体摩尔体积、阿伏伽德罗常数的关系即可解答,试题培养了学生的化学计算能力.


 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:选择题
| A. | 用25 mL量筒量取12.36 mL盐酸 | |
| B. | 用pH试纸测出某溶液pH为3.5 | |
| C. | 用托盘天平称取8.75 g食盐 | |
| D. | 用酸式滴定管测出消耗盐酸的体积为15.60 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 标准状况下,22.4LH2O含有的分子数为 NA | |
| B. | 4.4g二氧化碳气体中所含的原子个数与4.2g氮气中所含的原子个数不相等 | |
| C. | 常温常压下,11.2LNH3所含的原子数目为2NA | |
| D. | 常温常压下,48gO3含有的氧原子数为3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 砷(As)是第四周期第VA族元素,它在自然界中的含量不高,但人类认识它、研究它的历史却很长.
砷(As)是第四周期第VA族元素,它在自然界中的含量不高,但人类认识它、研究它的历史却很长.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

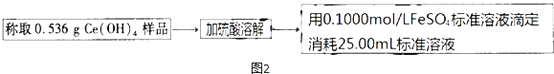
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
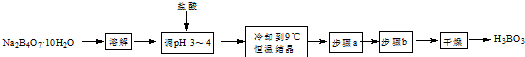
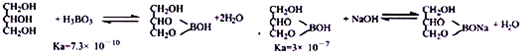
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
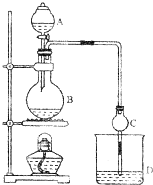 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、乙酸,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、乙酸,D中放有饱和碳酸钠溶液.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com