
| A£® | ŹµŃé¢ŁÖŠ²śÉśµÄĘųĢåĪŖ°±Ęų£¬²¢æɵĆŌČÜŅŗÖŠc£ØNH4+£©=0.2 mol•L-1 | |
| B£® | ŹµŃé¢ŪÖŠµÄ°×É«³ĮµķÖŠŅ»¶ØÓŠBaSO4£¬ĪŽBaCO3 | |
| C£® | ŌČÜŅŗÖŠŅ»¶ØÓŠK+£¬ĒŅc£ØK+£©=0.4 mol•L-1 | |
| D£® | ČōŅŖÅŠ¶ĻŌČÜŅŗÖŠŹĒ·ńÓŠCl-£¬ĪŽŠčĮķĶāÉč¼ĘŹµŃéŃéÖ¤ |
·ÖĪö ŗĶ¹żĮæNaOHČÜŅŗ¼ÓČČ²śÉśµÄĘųĢåÖ»ÄÜŹĒ°±Ęų£¬æÉŅŌŗĶ¹żĮæµÄĒāŃõ»ÆÄĘ·“Ӧɜ³ÉµÄ³ĮµķæÉŅŌŹĒĒāŃõ»ÆĢś”¢ĒāŃõ»ÆĆ¾£¬ĒāŃõ»ÆĀĮæÉŅŌŗĶ¹żĮæµÄĒāŃõ»ÆÄĘÖ®¼ä·“Ó¦£¬ĻņĘ«ĀĮĖįÄĘÖŠĶعżĮæµÄ¶žŃõ»ÆĢ¼æÉŅŌµĆµ½ĒāŃõ»ÆĀĮ³Įµķ£¬ĒāŃõ»ÆĀĮ×ĘÉÕæÉŅŌµĆµ½Ńõ»ÆĀĮ£¬øł¾ŻĀĮŌŖĖŲŹŲŗćæÉŅŌ¼ĘĖćĀĮĄė×ÓµÄĮ棬ŌŚČÜŅŗÖŠ£¬ĀĮĄė×ÓŗĶĢ¼ĖįøłĄė×ÓŅņĪŖĖ«Ė®½ā²»¹²“ę£¬ĮņĖįøłĄė×ÓæÉŅŌŗĶ±µĄė×ÓÖ®¼ä·“Ӧɜ³ÉĮņĖį±µ³Įµķ£¬ŹĒŅ»ÖÖ²»ČÜÓŚŃĪĖįµÄ°×É«³Įµķ£¬øł¾Ż³ĮµķµÄĮæ½įŗĻ·¢ÉśµÄ·“Ó¦Ą“¼ĘĖćĄė×ÓµÄĮ漓æÉ£®
½ā“š ½ā£ŗ¢ŁµŚŅ»·Ż¼Ó¹żĮæNaOHČÜŅŗŗó¼ÓČČ£¬ŹÕ¼Æµ½0.02molĘųĢ壬¼“ĪŖ°±Ęų£¬Ņ»¶Øŗ¬ÓŠNH4+£¬ĪļÖŹµÄĮæĪŖ0.02mol£¬ÅضČĪŖ$\frac{0.02mol}{0.05L}$=0.4mol/L£¬ĪŽ³ĮµķÉś³É£¬ŌņŅ»¶Ø²»ŗ¬ÓŠFe3+”¢Mg2+£»
¢ŚĻņ¼×ČÜŅŗÖŠĶØČė¹żĮæCO2£¬Éś³É°×É«³Įµķ£¬¼“ĪŖĒāŃõ»ÆĀĮ£¬ŌņŌČÜŅŗÖŠŅ»¶ØÓŠAl3+£¬Ņ»¶Ø²»ŗ¬ÓŠĢ¼ĖįøłĄė×Ó£¬ĀĮĄė×ÓŗĶ¹żĮæµÄĒāŃõ»ÆÄĘ·“Ӧɜ³ÉĘ«ĀĮĖįÄĘČÜŅŗ£¬ČÜŅŗÖŠĶØČė¹żĮæCO2£¬Éś³É°×É«³Įµķ£¬¼“ĪŖĒāŃõ»ÆĀĮ£¬ĒāŃõ»ÆĀĮ³Įµķ¾¹żĀĖ”¢Ļ“µÓ”¢×ĘÉÕŗó£¬µĆµ½1.02g¹ĢĢ弓ĪŖŃõ»ÆĀĮ£¬øł¾ŻĀĮŌŖĖŲŹŲŗć£¬µĆµ½ĀĮĄė×ÓµÄĪļÖŹµÄĮæŹĒ$\frac{1.02g}{102g/mol}$”Į2=0.02mol£¬ÅضČĪŖ$\frac{0.02mol}{0.05L}$=0.4mol/L£»
¢ŪµŚ¶ž·Ż¼Ó×ćĮæBaCl2ČÜŅŗŗó£¬Éś³É°×É«³Įµķ£¬ŌņŅ»¶Øŗ¬ÓŠĮņĖįøłĄė×Ó£¬ĪŽ±µĄė×Ó£®³Įµķ¾×ćĮæŃĪĖįĻ“µÓ”¢øÉŌļŗó£¬µĆµ½11.65g¹ĢĢ弓ĮņĖį±µµÄÖŹĮæŹĒ11.65g£¬ĪļÖŹµÄĮæĪŖ$\frac{11.65g}{233g/mol}$=0.05mol£¬øł¾ŻŌŖĖŲŹŲŗć£¬ĖłŅŌĮņĖįøłĄė×ÓµÄĪļÖŹµÄĮæŹĒ0.05mol£¬ÅضČĪŖ$\frac{0.05mol}{0.05L}$=1mol/L£¬×ŪÉĻæÉÖŖ£¬Ņ»¶Øŗ¬ÓŠµÄĄė×ÓŹĒ£ŗNH4+”¢Al3+”¢SO42-£¬ĘäÅØ¶Č·Ö±šŹĒ£ŗ0.4mol/L£»0.4mol/L£»1mol/L£¬Ņ»¶Ø²»ŗ¬Fe3+”¢Mg2+”¢Ba2+”¢CO32-”¢SO42£¬²»ÄÜČ·¶ØŹĒ·ń“ęŌŚĀČĄė×Ó£»
A£®øł¾ŻŅŌÉĻ·ÖĪöæÉÖŖ£¬c £ØNH4+£©=0.4 mol•L-1£¬¹ŹA“ķĪó£»
B£®øł¾ŻŅŌÉĻ·ÖĪöæÉÖŖ£¬¢ŪÖŠµÄ°×É«³ĮµķÖŠŅ»¶ØÓŠBaSO4£¬ĪŽBaCO3£¬¹ŹBÕżČ·£»
C£®ČĪŗĪČÜŅŗÖŠ¶¼“ęŌŚµēŗÉŹŲŗć£¬NH4+”¢Al3+”¢SO42-£¬ĘäÅØ¶Č·Ö±šŹĒ£ŗ0.4mol/L£»0.4mol/L£»1mol/L£¬æÉŅŌÖŖµĄNH4+”¢Al3+µÄÕżµēŗÉ×ÜĮæŠ”ÓŚSO42-øŗµēŗÉ×ÜĮ棬ŅĄ¾ŻµēŗÉŹŲŗć£¬ŌņŅ»¶ØÓŠK+“ęŌŚ£¬ČōĪŽĀČĄė×Ó“ęŌŚ£¬
Ōņ0.4”Į1+0.4”Į3+c£ØK+£©”Į1=1”Į2£¬½āµĆc£ØK+£©=0.4mol/L£¬ČēÓŠĀČĄė×Ó“ęŌŚ£¬Ōņc£ØK+£©”Ż0.4mol/L£¬¹ŹC“ķĪó£»
D£®ÓÉŅŌÉĻ·ÖĪöæÉÖŖ£¬²»ÄÜČ·¶Ø“ęŌŚĀČĄė×Ó£¬¹ŹD“ķĪó£»
¹ŹŃ”B£®
µćĘĄ ±¾Ģāæ¼²éĄė×ӵļģŃ飬²ÉÓĆ¶ØŠŌŹµŃéŗĶ¶ØĮæ¼ĘĖć·ÖĪöĻą½įŗĻµÄÄ£Ź½£¬Ōö“óĮĖ½āĢāÄŃ¶Č£¬Ķ¬Ź±Éę¼°Ąė×Ó¹²“ę”¢Ąė×Ó·“Ó¦µČ¶¼ŹĒ½āĢāŠč×¢ŅāµÄŠÅĻ¢£¬ÓČĘäŹĒK+µÄČ·¶ØŅ׳öĻÖŹ§Īó£®


 ĒÉѧĒÉĮ·ĻµĮŠ“š°ø
ĒÉѧĒÉĮ·ĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | °±ĘųĶØČė“×ĖįČÜŅŗCH3COOH+NH3ØTCH3COONH4 | |
| B£® | ³ĪĒåµÄŹÆ»ŅĖ®øśŃĪĖį·“Ó¦H++OH-ØTH2O | |
| C£® | Ģ¼Ėį±µČÜÓŚ“×ĖįBaCO3+2H+ØTBa2++H2O+CO2”ü | |
| D£® | ½šŹōÄĘøśĖ®·“Ó¦Na+H2OØTNa ++OH-+H2”ü |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¢Ł¢Ś¢Ż | B£® | ¢Ł¢Ū¢Ž | C£® | ¢Ś¢Ü¢Ż | D£® | ¢Ł¢Ś¢Ü |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ģś¶¤ŌŚæÕĘųÖŠ³öĻÖŗģÉ«µÄĢśŠā£¬Ęäøŗ¼«·“Ó¦Ź½ĪŖ£ŗFe-3e-ØTFe3+ | |
| B£® | ĒāŃõ»ÆĆ¾°×É«³ĮµķČÜÓŚĀČ»Æļ§ČÜŅŗ£ŗMg£ØOH£©2+NH4+ØTMg2++NH3•H2O | |
| C£® | Ļņ×ćĮæĀĮ·ŪÓėĒāŃõ»ÆÄĘČÜŅŗ·“Ó¦ŗóµÄČÜŅŗÖŠµĪ¼ÓĢ¼ĖįĒāÄĘČÜŅŗ£ŗHCO3-+AlO2-+H2OØTAl£ØOH£©3”ż+CO32- | |
| D£® | ĘÆ°×·ŪČÜŅŗÖŠ¼ÓĀČ»ÆŃĒĢśČÜŅŗ²śÉś“óĮæ³Įµķ£ŗFe2++2ClO-+2H2OØTFe£ØOH£©2”ż+2HClO |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | µĪ¼Ó×ćĮæµÄNaOHČÜŅŗŗ󣬹żĀĖĻ“µÓ×ĘÉÕ£¬×īÖÕ¹ĢĢåĪŖ72g | |
| B£® | ¼ÓČė¹żĮæĻ”ĮņĖį£¬²śÉśµÄĘųĢåÓöæÕĘųÄܱä³Éŗģ×ŲÉ« | |
| C£® | ¼ÓČĖ¹żĮæµÄĻ”ĮņĖįŗĶKSCNČÜŅŗ£¬ČÜŅŗĻŌŃŖŗģÉ« | |
| D£® | øĆČÜŅŗÖŠĖłŗ¬µÄĄė×ÓŹĒ£ŗFe2+”¢Na+”¢SO42-”¢NO3- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| ŃōĄė×Ó | H+ Na+ Al3+ Ag+ Ba2+ |
| ŅõĄė×Ó | OH- Cl- CO32- NO3- SO42- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
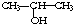 ÓėNaOHµÄ“¼ČÜŅŗ¹²ČČÖʱøCH3-CHØTCH2
ÓėNaOHµÄ“¼ČÜŅŗ¹²ČČÖʱøCH3-CHØTCH2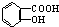 ÓėŹŹĮæNaHCO3ČÜŅŗ·“Ó¦Öʱø
ÓėŹŹĮæNaHCO3ČÜŅŗ·“Ó¦Öʱø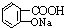
| A£® | Ö»ÓŠ¢Ł¢Ū¢Ü | B£® | Ö»ÓŠ¢Ł¢Ü | C£® | Ö»ÓŠ¢Ł | D£® | ¶¼²»ÄÜ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
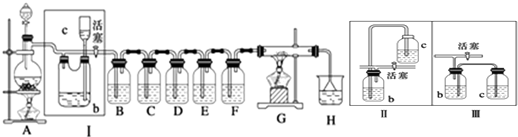
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com