
 盐酸和氢氧化钠是工业上重要的化工原料,也是实验室里常见的试剂.
盐酸和氢氧化钠是工业上重要的化工原料,也是实验室里常见的试剂.分析 Ⅰ.(1)根据中和热是强酸和强碱的稀溶液完全反应生成1mol水放出的热量,标注物质聚集状态和对应焓变写出热化学方程式;
(2)a.装置保温、隔热效果差,测得的热量偏小;
b.分多次把NaOH溶液倒入盛有盐酸的小烧杯中,热量散失较多;
c.量取盐酸的体积时仰视读数,会导致所量的盐酸体积偏大,放出的热量偏高;
d.用温度计测定NaOH溶液起始温度后直接测定盐酸的温度,盐酸的起始温度偏高;
Ⅱ.(1)根据中和滴定实验的仪器有:酸式滴定管、碱式滴定管、锥形瓶、铁架台;
(2)酸碱中和滴定时,眼睛要注视锥形瓶内溶液的颜色变化;滴定终点时溶液颜色由红色突变为无色;
(3)根据滴定管的结构和精确度以及测量的原理:NaOH+HCl=NaCl+H2O来解答;
(4)根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差.
解答 解:Ⅰ.(1)强酸强碱的中和热为-57.3kJ/mol,即强酸和强碱的稀溶液完全反应生成1mol水放出的热量为57.3kJ,则稀盐酸和稀氢氧化钠溶液反应的中和热的热化学方程式:HCl (aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-57.3 kJ/mol;
故答案为:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-57.3 kJ/mol;
(2)a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.分多次把NaOH溶液倒入盛有盐酸的小烧杯中,热量散失较多,中和热的数值偏小,故b正确;
c.量取盐酸的体积时仰视读数,会导致所量的盐酸体积偏大,放出的热量偏高,中和热的数值偏大,故c错误;
d.用温度计测定NaOH溶液起始温度后直接测定盐酸的温度,盐酸的起始温度偏高,温度差偏小,中和热的数值偏小,故d正确;
故选abd;
Ⅱ.(1)中和滴定实验的仪器有:酸式滴定管、碱式滴定管、锥形瓶、铁架台,实验中不必用到的是容量瓶,故选a.
(2)酸碱中和滴定时,眼睛要注视锥形瓶内溶液的颜色变化,滴定终点时溶液颜色由红色突变为无色,且半分钟内不褪色,且半分钟内不褪色,
故答案为:锥形瓶中溶液颜色的变化;红;无;
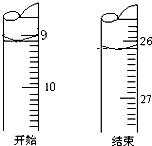
(3)起始读数为9.00mL,终点读数为26.10mL,消耗的盐酸溶液的体积为17.10mL,用c(HCl)=1.0×10-2mol/L的盐酸标定25mL的氢氧化钠溶液,发生NaOH+HCl=NaCl+H2O,则满足V(HCl)×c(HCl)=V(NaOH)×c(NaOH),c(NaOH)=$\frac{1.0×1{0}^{-2}mol/L×17.10mL}{25mL}$=0.0068mol/L;
故答案为:9.00;26.10;0.0068;
(4)a、碱式滴定管未用待测液润洗就直接注入待测氢氧化钠溶液,待测液的浓度偏小,物质的量偏小,造成V(标准)偏小,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$可知,测定c(NaOH)偏小,故a错误;
b、锥形瓶用蒸馏水洗净后没有干燥,待测液的物质的量不变,对V(标准)无影响,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$可知,测定c(NaOH)无影响,故b错误;
c、酸式滴定管在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$可知,测定c(NaOH)偏大,故c错误;
d、读取盐酸体积时,开始仰视读数,滴定结束时俯视读数,造成V(标准)偏小,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$可知,测定c(NaOH)偏低,故d正确;
故答案为:ad.
点评 本题主要考查了中和滴定操作与误差分析,侧重于学生的分析、实验和计算能力的考查,难度不大,注意中和滴定的原理、酸碱中和时H+的物质的量与OH-离子的物质的量相等,把握误差分析.


科目:高中化学 来源: 题型:选择题
| A. | 容器内压强不随时间变化 | |
| B. | 容器内各物质的浓度不随时间变化 | |
| C. | 容器内O2、NO、NO2的浓度之比为1:2:2 | |
| D. | 单位时间内生成1mol O2,同时生成0.2mol NO2 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁沈阳东北育才学校高二阶段考一化学卷(解析版) 题型:选择题
恒温条件下,将NO2装入带活塞的密闭容器中,当反应2NO2(g) N2O4(g)达到平衡后,慢慢压缩气体体积,下列叙述正确的是( )
N2O4(g)达到平衡后,慢慢压缩气体体积,下列叙述正确的是( )
A.若体积减小一半,压强增大,V正增大,V逆减小
B.平衡向右移动,混合气体颜色一定会变浅
C.若体积减小一半,压强增大,但小于原来的两倍
D.平衡向右移动,混合气体的平均相对分子量减小
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向红褐色的Fe(OH)3固体中加入过量盐酸 | |
| B. | 等物质的量浓度、等体积的(NH4)2SO4与BaCl2溶液 | |
| C. | 等物质的量的NaHCO3与Na2O2固体 | |
| D. | 向NaBr溶液中通入过量氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5 mol | B. | 0.95 mol | C. | 0.67 mol | D. | 1 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(HCO3)2溶液中加入过量NaOH溶液Ca2++HCO3-+OH-=CaCO3↓+H2O | |
| B. | SO2通入溴水中SO2+Br2+2H2O═4H++2Br-+SO42- | |
| C. | 泡沫灭火器原理:2Al3++3CO32-+3H2O═2Al(OH)3↓+3CO2↑ | |
| D. | FeO与稀HNO3反应FeO+2H+═Fe2++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 采用原煤脱硫技术,可减少燃煤产生的SO2 | |
| B. | 晶体硅可以制作太阳能电池板 | |
| C. | 自来水厂可用氯气来杀菌消毒,因此氯气无毒 | |
| D. | 分散系中分散质粒子的直径:Fe(OH)3 悬浊液>Fe(OH)3 胶体>FeCl3 溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com