
| A. | 单质的颜色随核电荷数的增加而加深 | |
| B. | 单质的熔、沸点随核电荷数的增加而升高 | |
| C. | 被其他卤素单质从其卤化物中置换出来的可能性随核电荷数的增加而增大 | |
| D. | 它们的氢化物的稳定性随核电荷数的增加而增强 |
分析 A.卤素单质的颜色从上到下逐渐加深;
B.卤素单质都是分子晶体,分子晶体熔沸点与其相对分子质量成正比;
C.元素的非金属性越强,其简单阴离子的还原性越弱;
D.元素的非金属性越强,其氢化物的稳定性越强.
解答 解:A.F2、Cl2、Br2、I2单质的颜色分别是浅黄绿色、黄绿色、深红棕色和紫黑色,即其颜色逐渐加深,故A正确;
B.卤素单质都是分子晶体,分子晶体熔沸点与其相对分子质量成正比,随着原子序数增大其单质的相对分子质量增大,所以其单质的熔沸点随着原子序数增大而增大,故B正确;
C.元素的非金属性越强,其简单阴离子的还原性越弱,其非金属性随着原子序数增大而减弱,所以简单阴离子的还原性随着原子序数增大而增强,则被其他卤素单质从其卤化物中置换出来的可能性随核电荷数的增加而增大,故C正确;
D.元素的非金属性越强,其氢化物的稳定性越强,随着原子序数增大其非金属性减弱,所以其氢化物的稳定性随着原子序数增大而减弱,故D错误;
故选D.
点评 本题考查同一主族元素结构性质递变规律,为高频考点,明确结构与性质关系是解本题关键,知道非金属性强弱判断方法,题目难度不大.


 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:填空题
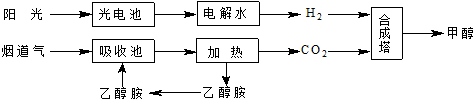
| 反应时间/min | 3 | 5 | 7 | 10 | 13 |
| c(CO2)/mol•L-1 | 0.50 | 0.37 | 0.30 | 0.25 | 0.25 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | TiCl4溶于大量水加热制备TiO2 | |
| B. | FeCl3饱和溶液滴入沸水中制Fe(OH)3胶体 | |
| C. | 配制氯化亚铁溶液时需加少量铁粉 | |
| D. | 将氯化铝溶液加热蒸干并灼烧,最后得到的固体是氧化铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4、C2H4 | B. | CH4、C3H6 | C. | C2H4、C3H6 | D. | C2H2、C3H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com