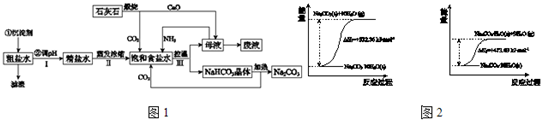
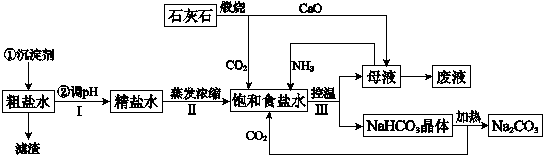
解:(1)钙离子会与碳酸根离子生成沉淀,Ca
2++CO
32-=CaCO
3↓,镁离子会与氢氧根离子生成沉淀,Mg
2++2OH
-=Mg(OH)
2↓,
故答案为:CaCO
3、Mg(OH)
2;
(2)向分离出NaHCO
3晶体后的母液中加入过量生石灰,发生的反应有H
2O+CaO=Ca(OH)
2、Ca(OH)
2+2NH
4Cl=2NH
3↑+2H
2O+CaCl
2,最终产物为氯化钙、氨气,其中氨气可再利用;
故答案为:2NH
4Cl+CaO=CaCl
2+2NH
3↑+H
2O;
(3)因二氧化碳在水中的溶解度小,氨气极易溶于水,所以,向饱和食盐水中首先通入氨气体,碳酸氢钠的溶解度小,利用浓碳酸氢铵溶液与氯化钠固体发生复分解反应,
故答案为:NH
3;NH
3+H
2O+CO
2+NaCl=NaHCO
3↓+NH
4Cl;
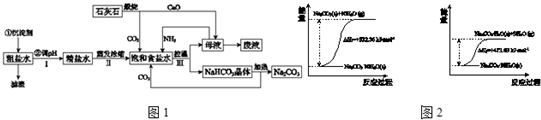
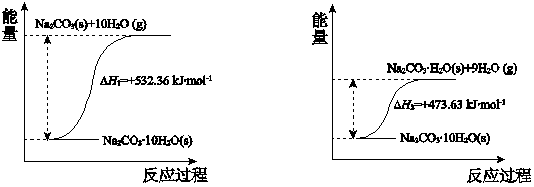
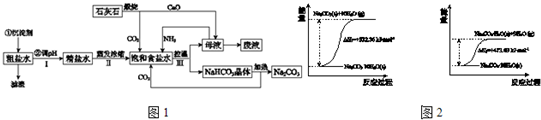
(4)根据碳酸钠晶体失水的能量变化示意图可知:Na
2CO
3?10H
2O(s)=Na
2CO
3(s)+10H
2O(g)△H=+532.36 kJ?mol
-1①,Na
2CO
3?10H
2O(s)=Na
2CO
3?H
2O(s)+9H
2O(g)△H=+473.63 kJ?mol
-1②,由①-②得Na
2CO
3?H
2O(s)=Na
2CO
3(s)+H
2O(g)△H=+58.73 kJ?mol
-1,
故答案为:Na
2CO
3?H
2O(s)=Na
2CO
3(s)+H
2O(g)△H=+58.73 kJ?mol
-1;
(5)产品纯碱中常含有NaCl,取a g混合物与足量稀盐酸充分反应,Na
2CO
3+2HCl=2NaCl+H
2O+CO
2↑,得b g固体为NaCl,设碳酸钠的物质的量为X,根据方程式Na
2CO
3+2HCl=2NaCl+H
2O+CO
2↑
1 2
X 2x
混合物质量:117x+a-106X=b,X=
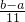
mol,该产品中Na
2CO
3的质量分数
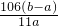
×100%,
故答案为:
;
(6)甲烷--空气燃料电池,电池的电极反应式为:总反应为CH
4+2O
2=CO
2+2H
2O,熔融Na
2CO
3作甲烷--空气燃料电池的电解质,燃料在正极发生还原反应为O
2+4e
-+2CO
2=2CO
32-,负极上失电子发生氧化反应,甲烷燃烧能生成二氧化碳和水,所以负极电极反应式为:CH
4-8e
-+4CO
32-=5CO
2+2H
2O,
故答案为:CH
4-8e
-+4CO
32-=5CO
2+2H
2O;
分析:(1)钙离子会与碳酸根离子生成沉淀,镁离子会与氢氧根离子生成沉淀;
(2)生石灰和水反应生成氢氧化钙,氢氧化钙和氯化铵反应生成氨气;
(3)食盐、氨气、水和二氧化碳发生化学反应,生成碳酸氢铵和氯化铵,据此书写化学方程式;
(4)根据碳酸钠晶体失水的能量变化示意图结合热效应解答;
(5)根据Na
2CO
3+2HCl=2NaCl+H
2O+CO
2↑进行计算;
(6)电池的电极反应式为:总反应为CH
4+2O
2=CO
2+2H
2O,根据负极上发生反应的反应类型确定反应的物质及电极反应式;
点评:本题主要考查了碳酸钠的制备,解题须熟练掌握侯氏制碱法的原理、原电池的工作原理,题目较为综合,难度中等.

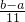 mol,该产品中Na2CO3的质量分数
mol,该产品中Na2CO3的质量分数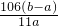 ×100%,
×100%,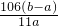 ;
;