
元素A的各级电离能数据如下:
| I1 | I2 | I3 | I4 | I5 | I6 | |
| I/kJ·mol-1 | 578 | 1 817 | 2 745 | 11 578 | 14 831 | 18 378 |
则元素A的常见价态是( )
A.+1 B.+2 C.+3 D.+6
 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
溴主要以Br-形式存在于海水中,海水呈弱碱性。工业上制备Br2的操作步骤为
①一定条件下,将Cl2通入浓缩的海水中,生成Br2
②利用热空气将Br2吹出,并用浓Na2CO3溶液吸收,生成NaBr、NaBrO3等
③用硫酸酸化步骤②得到的混合物
完成下列填空:
(1)Cl2氧化Br-应在__________条件下进行,目的是为了避免_________________。
(2)Br2可用热空气吹出,其原因是________________________________________。
(3)写出步骤③所发生的化学反应方程式___________________________________。
用硫酸而不用盐酸酸化的原因可能是______________。步骤②的产品有时运输到目的地后再酸化,主要是因为________________________________________________________
________________________________________________________________________。
(4)为了除去工业Br2中微量的Cl2,可向工业Br2中
________________________________________________________________________
a.通入HBr
b.加入Na2CO3溶液
c.加入NaBr溶液
d.加入Na2SO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应X(g)+Y(g)2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是( )
A.反应前2 min的平均速率v(Z)=2.0×10-3mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2 mol Z,平衡时X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
铁是最常见的金属之一,铁可以形成多种氧化物、氢氧化物和盐类。铁与二氧化碳、水在某一密闭体系中反应情况如下表所示:
| 化学反应 | 平衡常数 | 温度 | |
| 973K | 1 173K | ||
| ①Fe(s)+CO2(g)FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
| ②Fe(s)+H2O(g)FeO(s)+H2(g) | K2 | 2.38 | 1.67 |
| ③CO(g)+H2O(g)CO2(g)+H2(g) | K3 | ? | ? |
完成下列填空:
(1)反应①为______(填“吸热”或“放热”)反应。根据反应①与②可以推导出同温下K1、K2与K3之间的关系,则K3=______(用K1、K2表示)。
(2)973 K时,若反应③在一个容积为2 L的反应容器内2 min时达到平衡,有3 mol电子发生转移,则在2 min内v(CO2)=____________。若压缩容器的容积为原来的一半,平衡将______移动(填“向左”、“向右”或“不”),CO2的浓度将______(填“增大”、“减小”或“不变”)。使该反应的平衡转化率及平衡常数都增大的措施有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某元素的逐级电离能(kJ·mol-1)分别为740、1 500、7 700、10 500、13 600、18 000、21 700,当它与氯反应时最可能生成的阳离子是( )
A.X+ B.X2+
C.X3+ D.X4+
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组中的两种固态物质熔化(或升华)时,克服的微粒间相互作用力属于同种类型的是( )
A.碘和碘化钠
B.金刚石和重晶石
C.冰醋酸和硬脂酸甘油酯
D.干冰和二氧化硅
查看答案和解析>>
科目:高中化学 来源: 题型:
答案 (1)1∶3
(2)①2NO2+2NaOH===NaNO3+NaNO2+H2O
②NaNO2
(3)①Na2CO3+2NO2===NaNO3+NaNO2+CO2
②NaNO3:0.05 mol NaNO2:0.15 mol 0.5
解析 (1)设NO的体积为V(NO),NO2的体积为V(NO2),依据方程式知,处理NO需NH3: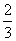 V(NO),处理NO2需NH3:
V(NO),处理NO2需NH3: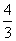 V(NO2),则
V(NO2),则
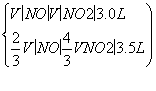
解得V(NO)=0.75 L
V(NO2)=2.25 L
V(NO)∶V(NO2)=1∶3。
(2)①生成两种钠盐,必然是NO2的歧化反应,依据量的关系可知两种盐分别为NaNO3和NaNO2。
②NO中氮的化合价为+2价,NO2中氮的化合物为+4价,二者1∶1混合时与NaOH反应生成一种钠盐,依据电子守恒可知,钠盐中氮的化合价为+3,即为NaNO2。
(3)②n(NO2)=0.15 mol,n(NO)=0.05 mol
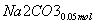 +
+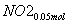 +
+ ===
===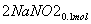 +CO2
+CO2
则单独与Na2CO3反应的NO2为0.15 mol-0.05 mol=0.1 mol
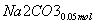 +
+ ===
===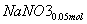 +
+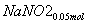 +CO2
+CO2
所以共生成NaNO3:0.05 mol,NaNO2:0.15 mol
c(Na2CO3)= =0.5 mol·L-1。
=0.5 mol·L-1。
★ ★★
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com