
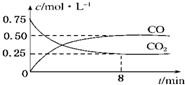
 某温度下,在一密闭容器中充入一定量CO2,并加入足量铁粉,发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g),测得CO2和CO浓度随时间的变化如图所示:
某温度下,在一密闭容器中充入一定量CO2,并加入足量铁粉,发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g),测得CO2和CO浓度随时间的变化如图所示:| c(CO) |
| c(CO2) |
| 温度/K | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
| △C |
| △t |
| c(CO) |
| c(CO2) |
| c(CO).c(H2O) |
| c(CO2).c(H2) |
| c(CO) |
| c(CO2) |
| 1 | ||
|
| K1 |
| K2 |
| K1 |
| K2 |
| △C |
| △t |
| 0.50-0 |
| 8 |
| c(CO) |
| c(CO2) |
| c(CO) |
| c(CO2) |
| c(CO) |
| c(CO2) |
| c(CO) |
| c(CO2) |
| c(CO) |
| c(CO2) |
| c(CO).c(H2O) |
| c(CO2).c(H2) |
| c(CO) |
| c(CO2) |
| 1 | ||
|
| K1 |
| K2 |
| 1.47 |
| 2.38 |
| 2.15 |
| 1.67 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、T℃时,两饱和溶液中c(Ca2+ ):CaCO3>CaF2 |
| B、T℃时,两饱和溶液等体积混合,会析出CaF2固体 |
| C、T℃时,CaF2固体在稀盐酸中的Ksp比在纯水中的Ksp大 |
| D、T℃时,向CaCO3悬浊液中加NaF固体,可能析出CaF2固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃时,0.1 mol?L-1 HF溶液中pH=1 |
| B、Ksp(CaF2)随温度和固体质量的变化而变化 |
| C、该体系中没有沉淀产生 |
| D、在原HF和NaF混合液中,2c(Na+)=c(F-)+c(HF) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | X | Y | Z |
| 初始物质的量(mol) | 0.2 | 0.2 | 0 |
| 平衡物质的量(mol) | 0.1 | 0.05 | 0.1 |
| A、反应可表示为2X+3Y?2Z,其平衡常数为8000 |
| B、增大压强使平衡向生成Z的方向移动,平衡常数增大 |
| C、若将容器的体积压缩至1L,则X的体积分数减小,浓度增大 |
| D、若升高温度时,Z的浓度增大,可知温度升高时正反应速率增大,逆反应速率减小,平衡朝正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
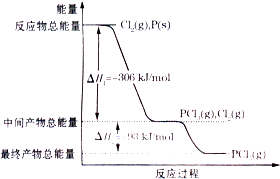 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).下列说法正确的是( )
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).下列说法正确的是( )| A、P(s)和Cl2(g)一步直接生成1 mol PCl5(g) 的△H小于△H1+△H2 |
| B、PCl5(g)?PCl3(g)+Cl2(g)加入催化剂,达平衡时PCl5的分解率减小 |
| C、生成PCl3(g)的热化学方程式为2P(s)+3Cl2(g)=2PCl3(g)△H=-306 KJ/mol |
| D、工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,降温后,再和Cl2反应生成PCl5,这样有助于提高产率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有CO32-和OH- |
| B、NaHCO3溶液中:[H]++[H2CO3]=[OH-] |
| C、10 mL 0.10 mol?L-1 CH3COOH溶液加入等物质的量的NaOH后,溶液中离子的浓度由大到小的顺序是:[Na+]>[CH3COO-]>[OH-]>[H+] |
| D、中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com