
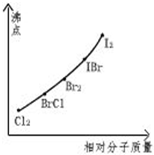
 Ā±ĖŲ»„»ÆĪļŹĒÖø²»Ķ¬Ā±ĖŲŌ×ÓÖ®¼äŅŌ¹²¼Ū¼ü½įŗĻŠĪ³ÉµÄ»ÆŗĻĪļ£¬xx£¬ŠĶĀ±ĖŲ»„»ÆĪļÓėĀ±ĖŲµ„ÖŹ½į¹¹ĻąĖĘ£¬ŠŌÖŹĻą½ü£®ŹŌ»Ų“šĻĀĮŠĪŹĢā£ŗ
Ā±ĖŲ»„»ÆĪļŹĒÖø²»Ķ¬Ā±ĖŲŌ×ÓÖ®¼äŅŌ¹²¼Ū¼ü½įŗĻŠĪ³ÉµÄ»ÆŗĻĪļ£¬xx£¬ŠĶĀ±ĖŲ»„»ÆĪļÓėĀ±ĖŲµ„ÖŹ½į¹¹ĻąĖĘ£¬ŠŌÖŹĻą½ü£®ŹŌ»Ų“šĻĀĮŠĪŹĢā£ŗ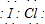 £¬Š“³öøĆĪļÖŹÓėNaOHČÜŅŗ·“Ó¦µÄ»Æѧ·½³ĢŹ½2NaOH+IClØTNaCl+NaIO+H2O
£¬Š“³öøĆĪļÖŹÓėNaOHČÜŅŗ·“Ó¦µÄ»Æѧ·½³ĢŹ½2NaOH+IClØTNaCl+NaIO+H2O·ÖĪö £Ø1£©ĀČ»Æµā½į¹¹ŗĶĀČĘųĻąĖĘ£¬ClŌ×ÓŗĶIŌ×ÓÖ®¼ä¹²ÓĆŅ»¶Ōµē×Ó£¬IClŗĶĀ±ĖŲµ„ÖŹ½į¹¹ĻąĖĘ£¬ŠŌÖŹĻą½ü£¬ŅĄ¾ŻĀČĘųŗĶĒāŃõ»ÆÄĘ·“Ӧɜ³ÉĀČ»ÆÄĘ”¢“ĪĀČĖįÄĘŗĶĖ®Š“³ö»Æѧ·½³ĢŹ½£»
£Ø2£©KIÓėIBr·“Ӧɜ³Éäå»Æ¼ŲŗĶµā£»
£Ø3£©øł¾Ż·Ö×Ó¾§ĢåČŪ·ŠµćÓėĘäĻą¶Ō·Ö×ÓÖŹĮæµÄ¹ŲĻµ½ā“š£»
£Ø4£©·Ö×Ó¾§ĢåµÄČŪ·ŠµćĖę·Ö×ÓĮæµÄŌö“ó¶ųÉżøߣ®
½ā“š ½ā£ŗ£Ø1£©ĀČ»Æµā½į¹¹ŗĶĀČĘųĻąĖĘ£¬ClŌ×ÓŗĶIŌ×ÓÖ®¼ä¹²ÓĆŅ»¶Ōµē×Ó£¬ĖłŅŌĀČ»ÆµāµÄµē×ÓŹ½ĪŖ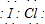 £¬IClŗĶĀ±ĖŲµ„ÖŹ½į¹¹ĻąĖĘ£¬ŠŌÖŹĻą½ü£¬ŅĄ¾ŻĀČĘųŗĶĒāŃõ»ÆÄĘ·“Ӧɜ³ÉĀČ»ÆÄĘ”¢“ĪĀČĖįÄĘŗĶĖ®Š“³ö»Æѧ·½³ĢŹ½ĪŖ£ŗ2NaOH+IClØTNaCl+NaIO+H2O£¬
£¬IClŗĶĀ±ĖŲµ„ÖŹ½į¹¹ĻąĖĘ£¬ŠŌÖŹĻą½ü£¬ŅĄ¾ŻĀČĘųŗĶĒāŃõ»ÆÄĘ·“Ӧɜ³ÉĀČ»ÆÄĘ”¢“ĪĀČĖįÄĘŗĶĖ®Š“³ö»Æѧ·½³ĢŹ½ĪŖ£ŗ2NaOH+IClØTNaCl+NaIO+H2O£¬
¹Ź“š°øĪŖ£ŗ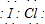 £» 2NaOH+IClØTNaCl+NaIO+H2O£»
£» 2NaOH+IClØTNaCl+NaIO+H2O£»
£Ø2£©KIÓėIBr·“Ӧɜ³Éäå»Æ¼ŲŗĶµā£¬·“Ó¦·½³ĢŹ½ĪŖKI+IBr=KBr+I2£¬
¹Ź“š°øĪŖ£ŗKI+IBrØTKBr+I2£»
£Ø3£©·Ö×Ó¾§ĢåµÄČŪ·ŠµćÓėĘäĻą¶Ō·Ö×ÓÖŹĮæ³ÉÕż±Č£¬Ļą¶Ō·Ö×ÓÖŹĮæŌ½“óĘäČŪ·ŠµćŌ½øߣ¬
¹Ź“š°øĪŖ£ŗ·Ö×Ó¾§ĢåµÄČŪ·ŠµćĖę·Ö×ÓĮæµÄŌö“ó¶ųÉżøߣ»
£Ø4£©·Ö×Ó¾§ĢåµÄČŪ·ŠµćĖę·Ö×ÓĮæµÄŌö“ó¶ųÉżøߣ¬ÕāČżÖÖĪļÖŹ¶¼ŹĒ·Ö×Ó¾§Ģ壬ĘäĻą¶Ō·Ö×ÓÖŹĮæŌ½“ó£¬øĆĪļÖŹµÄČŪ·ŠµćŌ½øߣ¬ĖłŅŌIClµÄ·ŠµćĖł“¦µÄ×īŠ”·¶Ī§£ŗBr2£¼ICl£¼IBr£¬¹Ź“š°øĪŖ£ŗBr2£¼ICl£¼IBr£®
µćĘĄ ±¾Ģāæ¼²éĮĖXX”ÆŠĶĀ±ĖŲ»„»ÆĪļµÄŠŌÖŹ¼°·Ö×Ó¾§ĢåČŪ·ŠµćµÄĢŲµćµČÖŖŹ¶µć£¬øł¾ŻĢāøųŃ”Ļī²ÉÓĆÖŖŹ¶ĒØŅʵķ½·Ø½ųŠŠ·ÖĪö½ā“š£¬ĢāÄæÄѶČÖŠµČ£®


 Ó¦ÓĆĢāĢģĢģĮ·ĖÄ“Ø“óѧ³ö°ęÉēĻµĮŠ“š°ø
Ó¦ÓĆĢāĢģĢģĮ·ĖÄ“Ø“óѧ³ö°ęÉēĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 3ÖÖ | B£® | 4ÖÖ | C£® | 5ÖÖ | D£® | 6ÖÖ |
²éæ““š°øŗĶ½āĪö>>
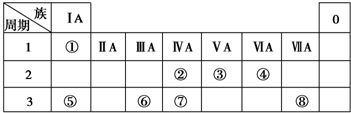
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | øĆŌŖĖŲŹōÓŚµŚ6ÖÜĘŚ | |
| B£® | øĆŌŖĖŲĪ»ÓŚIVA×å | |
| C£® | øĆŌŖĖŲĪŖ½šŹōŌŖĖŲ£¬ŠŌÖŹÓė82Pb£ØĒ¦£©ĻąĖĘ | |
| D£® | øĆŌŖĖŲŌ×Óŗ¬ÓŠ114øöµē×ÓŗĶ184øöÖŠ×Ó |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 ”ś
”ś
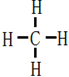 £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ½«×ćĮ涞Ńõ»ÆĮņĶØČėĖįŠŌøßĆĢĖį¼ŲČÜŅŗÖŠ£¬ČÜŅŗĶŹÉ«£¬ĖµĆ÷¶žŃõ»ÆĮņ¾ßÓŠ»¹ŌŠŌ | |
| B£® | ¶žŃõ»ÆĮņµÄĖ®ČÜŅŗÖŠµĪ¼ÓĀČ»Æ±µĪŽĻÖĻó£¬ŌŁ¼ÓČė0.5 mL 3%µÄ¹żŃõ»ÆĒāŗó²śÉś³Įµķ | |
| C£® | ¶žŃõ»ÆĮņÄÜĘÆ°×ijŠ©ĪļÖŹ£¬ĖµĆ÷Ėü¾ßÓŠŃõ»ÆŠŌ | |
| D£® | ¶žŃõ»ÆĮņĘÆ°×¹żµÄ²ŻĆ±¹żŅ»¶ĪŹ±¼äŗó±ä»Ę |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | »ÆѧÄÜ×Ŗ»Æ³É¹āÄÜ | B£® | »ÆѧÄÜ×Ŗ»Æ³ÉµēÄÜ | ||
| C£® | ¹āÄÜ×Ŗ»Æ³É»ÆѧÄÜ | D£® | µēÄÜ×Ŗ»Æ³É¹āÄÜ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
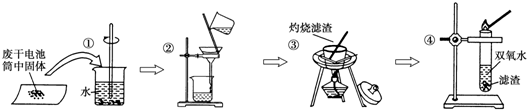
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
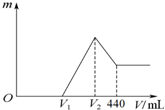
| A£® | V2=400mL | |
| B£® | 0”ÜV1£¼280mL | |
| C£® | ¼ÓČėNaOHČÜŅŗµÄ¹ż³ĢÖŠ£¬²śÉś³ĮµķµÄ×ī“óĮææÉÄÜĪŖ0.18mol | |
| D£® | µ±V1=160mLŹ±£¬n£ØMg£©=0.04mol |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com