
| A. | 在中和滴定中,既可用标准溶液滴定待测溶液,也可用待测溶液滴定标准溶液 | |
| B. | 进行中和滴定操作中,眼睛要始终注视滴定管内溶液液面的变化 | |
| C. | 测定中和热时,两烧杯间填满碎纸的作用是固定小烧杯 | |
| D. | 若用50mL 0.55mo1•L-1的氢氧化钠溶液,分别与50mL 0.50mo1•L-1的盐酸和50mL 0.50mo1•L-1的硫酸充分反应,两反应的中和热不相等 |
分析 A.中和滴定时,酸可滴定碱,也可碱滴定酸;
B.中和滴定中,眼睛观察锥形瓶内颜色的变化;
C.测定中和热时,两烧杯间填满碎纸,可防止热量散失;
D.中和热为酸、碱反应生成1mol水的能量变化.
解答 解:A.中和滴定时,酸可滴定碱,也可碱滴定酸,即中和滴定时可用标准溶液滴定待测液,也可用待测液滴定标准溶液,故A正确;
B.中和滴定中,眼睛观察锥形瓶内颜色的变化,可准确判断滴定终点,故B错误;
C.测定中和热时,两烧杯间填满碎纸,可防止热量散失,保证中和热的热量测定准确,故C错误;
D.中和热为酸、碱反应生成1mol水的能量变化,则用50mL 0.55mo1•L-1的氢氧化钠溶液,分别与50mL 0.50mo1•L-1的盐酸和50mL 0.50mo1•L-1的硫酸充分反应,中和热相同,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握中和滴定实验、中和热测定为解答的关键,侧重分析与实验能力的考查,注意实验操作和实验评价性分析,题目难度不大.


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:选择题
| A. | 只有①② | B. | 只有②③ | C. | 只有①②③ | D. | 全部正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径(×10-10m) | 0.37 | 1.86 | 1.43 | 0.99 | 0.75 | 0.74 | |
| 主要化合价 | 最高正价 | +1 | +1 | +3 | +7 | +5 | - |
| 最低负价 | -1 | - | - | -1 | -3 | -2 | |
| A. | 离子半径:Y>Z>M | |
| B. | Y、Z、M三种元素的最高价氧化物的水化物两两之间会反应 | |
| C. | 化合物XM、YM都是电解质.熔融状态下都能导电 | |
| D. | 元素Z、M、R的离子均能破坏水的电离平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在蒸馏水中滴加稀H2SO4,c(H+)和KW都增大 | |
| B. | 在Na2S稀溶液中,c(OH-)+c(HS-)+2c(S2-)═c(H+)+c(Na+) | |
| C. | NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 | |
| D. | 等体积0.2mol/LHCl溶液与0.05mol/LBa(OH)2溶液混合后,溶液的pH=1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CHO+H2$→_{△}^{催化剂}$CH3CH2OH | B. | CH2=CH2+HCl$\stackrel{一定条件}{→}$CH3CH2Cl | ||
| C. | 2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH | D. | 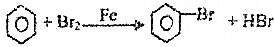 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④②⑤③ | B. | ④①②⑤③ | C. | ④②⑤①③ | D. | ⑤②④①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 v(NH3)=5 v(O2) | B. | 5 v(O2)=6 v(H2O) | C. | 5 v(NO)=4 v(O2) | D. | 3 v(H2O)=2 v(NH3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LCCl4中含有共价键的数目为4NA | |
| B. | 常温常压下,6.4 g氧气和臭氧中含有的原子总数为0.4NA | |
| C. | 室温时,1L pH=2的NH4Cl溶液中由水电离出的H+为10-12NA | |
| D. | 一定条件下6.4gSO2与足量氧气反应生成SO3,转移电子数为0.2 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com