
| A. | 0.10 mol•L-1的醋酸钠溶液20mL与0.10 mol•L-1盐酸10mL混合后溶液显酸性:c (CH3COO-)>c (Cl-)>c (H+)>c (CH3COOH) | |
| B. | pH=7的醋酸钠和醋酸混合液中:c(Na+)=c(CH3COO-)=c (H+)=c(OH-) | |
| C. | 若0.10 mol•L-1的醋酸的pH=a,0.010 mol•L-1的醋酸的pH=b,则a+1>b | |
| D. | 已知酸性HF>CH3COOH,pH相等的NaF与CH3COOK溶液中:[c(Na+)-c(F-)]<[c(K+)-c(CH3COO-)] |
分析 A、醋酸和醋酸钠的混合液显示酸性,可以确定电离程度和水解程度之间的大小关系;
B.溶液中的电荷守恒分析判断;
C.弱酸的电离度和溶液浓度有关,越稀越电离;
D.溶液中的电荷守恒和越弱越水解分析判断;
解答 解:A、0.1mol/L的醋酸钠溶液20mL与0.1mol/L盐酸10mL混合后,所得溶液是等浓度的氯化钠、醋酸以及醋酸钠的混合物,根据混合液显示酸性,可以确定醋酸的电离程度大于醋酸根离子的水解程度,则c (CH3COO-)>c(Cl-)>c (CH3COOH)>c(H+),故A错误;
B.醋酸钠和醋酸混合液中,pH=7则c(H+)=c(OH-),根据电荷守恒:c(H+)+c(Na+)=c(CH3COO-)+c(OH-),所以c(Na+)=c(CH3COO-),溶液中c(Na+)=c(CH3COO-)>c (H+)=c(OH-),故B错误;
C.0.1mol/L的醋酸的电离度小于0.01mol/L的醋酸的电离度,所以a+1>b,故C正确;
D.酸性HF>CH3COOH,NaF与CH3COOK溶液中,醋酸根离子的水解程度大于氟离子的水解程度,所以碱性醋酸钠强于氟化钠,在氟化钠中,c(Na+)-c(F-)=c(OH-)-c(H+),在醋酸钾中,c(K+)-c(CH3COO-)=c(OH-)-c(H+),pH相等的NaF与CH3COOK溶液中,氢离子浓度相等,则氢氧根浓度也相等,所以c(OH-)-c(H+)相等,即c(Na+)-c(F-)]=[c(K+)-c(CH3COO-),故D错误,
故选C.
点评 本题考查学生溶液中离子浓度之间的关系知识,属于综合知识的考查,要求学生具有分析和解决问题的能力,题目难度中等.


科目:高中化学 来源: 题型:解答题

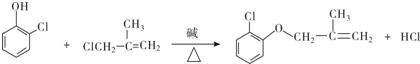 (有机物用结构简式表示,下同).
(有机物用结构简式表示,下同).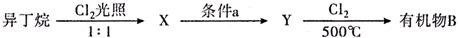
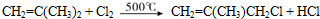 ;
;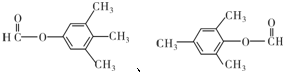
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
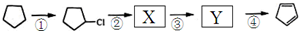

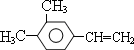 (任写一种).金刚烷与四氢二聚环戊二烯的关系是B.(填字母)
(任写一种).金刚烷与四氢二聚环戊二烯的关系是B.(填字母)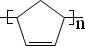 ..
.. .请写出下列反应的有机产物的结构简式:
.请写出下列反应的有机产物的结构简式: OHC-CHO、OHC-CH2-CHO.
OHC-CHO、OHC-CH2-CHO.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑦ | B. | ①③④ | C. | ②④⑥ | D. | ④⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 混合溶液的pH等于7 | B. | 混合溶液的pH大于7 | ||
| C. | 加入酸碱的物质的量相等 | D. | 混合溶液还能再中和盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 将镁片、铝片平行插入到一定浓度的NaOH溶液中,用导线连接成闭合回路,该装置在工作时,下列叙述正确的是( )
将镁片、铝片平行插入到一定浓度的NaOH溶液中,用导线连接成闭合回路,该装置在工作时,下列叙述正确的是( )| A. | 镁比铝活泼,镁失去电子被氧化成Mg2+ | |
| B. | 铝是电池负极,开始工作时溶液中会立即有白色沉淀生成 | |
| C. | 该装置的内、外电路中,均是电子的定向移动形成电流 | |
| D. | 该装置开始工作时,铝片表面的氧化膜可不必处理 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E为周期表中原子序数依次递增的前四周期元素.
A、B、C、D、E为周期表中原子序数依次递增的前四周期元素.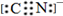 ,
,
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 431 | 366 | 298 | 436 |
| A. | 放出248 kJ 热量 | B. | 吸收248 kJ 热量 | C. | 放出183kJ热量 | D. | 吸收183 kJ热量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com