
分析 (1)加热后溶液红色变深,说明加热促进水解,水解平衡正向移动;CuSO4溶液投入到NaHCO3饱和溶液中,铜离子与碳酸氢根离子水解相互促进;
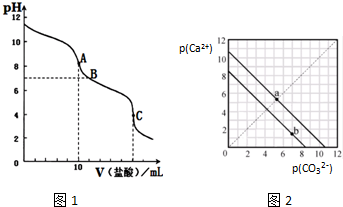
(2)①准确量取10.00mL0.1000mol•L-1的碳酸钠溶液,因碳酸钠溶液水解呈碱性,所用的仪器为 碱式滴定管或移液管,用甲基橙为指示剂滴定到C点时,因未滴定时溶液呈碱性,所以滴定终点现象为溶液由黄色变成橙色;
②当盐酸用量为5mL时,得到等物质量浓度的碳酸钠和碳酸氢钠溶液,碳酸根离子的水解程度大于碳酸氢根离子,溶液中c(CO32-)<c(HCO3-);水的电离程度比较:A点是恰好完全反应生成碳酸氢钠,而C点是酸过量;
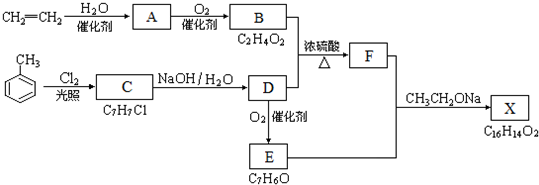
(3)CaCl2溶液的最小浓度时即钙离子与碳酸根离子达溶解平衡状态,设CaCl2溶液的最小浓度为x,则2×10-4×$\frac{1}{2}$×x×$\frac{1}{2}$=2.8×10-9,解之得x=5.6×10-5mol•L-1,由p(Ca2+)=-lgc(Ca2+),p(CO32-)=-lgc(CO32-)可知,p越大对就离子浓度越小,而a的p值大于b所以a点的Ksp较小,电离平衡逆向移动,温度降低.
解答 解:(1)碳酸钠是强碱弱酸盐,碳酸根离子水解CO32-+H2O?HCO3-+OH-:加热后溶液红色变深,说明加热促进水解,水解平衡正向移动;CuSO4溶液投入到NaHCO3饱和溶液中,铜离子与碳酸氢根离子水解相互促进,反应的化学方程式为:2Cu2++4HCO3-═Cu2(OH)2CO3↓+3CO2↑+H2O;故答案为:CO32-+H2O?HCO3-+OH-,水解为吸热过程,加热促进水解平衡正向移动;2Cu2++4HCO3-═Cu2(OH)2CO3↓+3CO2↑+H2O;
(2))①准确量取10.00mL0.1000mol•L-1的碳酸钠溶液,因碳酸钠溶液水解呈碱性,所用的仪器为 碱式滴定管或移液管,用甲基橙为指示剂滴定到C点时,因未滴定时溶液呈碱性,所以滴定终点现象为溶液由黄色变成橙色;,故答案为:(碱式)滴定管或移液管;最后一滴盐酸加入时,溶液由黄色变成橙色(半分钟不变色);
②当盐酸用量为5mL时,得到等物质量浓度的碳酸钠和碳酸氢钠溶液,碳酸根离子的水解程度大于碳酸氢根离子,溶液中c(CO32-)<c(HCO3-);水的电离程度比较:A点是恰好完全反应生成碳酸氢钠,碳酸氢钠的水解对水的电离起促进作用,而C点是酸过量,酸对水的电离起抑制作用,所以水的电离程度比较:A点>C点;故答案为:<;>;
(3)CaCl2溶液的最小浓度时即钙离子与碳酸根离子达溶解平衡状态,设CaCl2溶液的最小浓度为x,则2×10-4×$\frac{1}{2}$×x×$\frac{1}{2}$=2.8×10-9,解之得x=5.6×10-5mol•L-1,由p(Ca2+)=-lgc(Ca2+),p(CO32-)=-lgc(CO32-)可知,p越大对就离子浓度越小,而a的p值大于b所以a点的Ksp较小,电离平衡逆向移动,温度降低,故答案为:5.6×10-5;<.
点评 本题主要考查了沉淀溶解平衡曲线,掌握图线中pc(CO32-)、pM数值越大,实际浓度越小是解题的关键,难度中等.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:解答题
 ;
; ;
; B、
B、
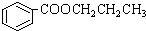
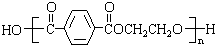 ,其合成单体为
,其合成单体为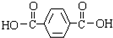 和HOCH2CH2OH;
和HOCH2CH2OH;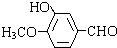 )的重要原料,写出同时满足下列条件的M的同分异构体的结构简式:
)的重要原料,写出同时满足下列条件的M的同分异构体的结构简式: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,2mol SO2与足量O2反应可得到2mol SO3 | |
| B. | 含4mol HCl 的浓盐酸与足量的MnO2加热反应可制备1mol Cl2 | |
| C. | 10ml 18.0 mol/L H2SO4与足量铜加热反应可制备0.09 mol SO2 | |
| D. | 一定条件下,1mol N2与3 mol H2反应可制备1.0 mol NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生石灰-Ca(OH)2 | B. | 小苏打-KHCO3 | C. | 重晶石-CaSO4 | D. | 醋酸-C2H4O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W<Y<Z | |
| B. | 简单气态氢化物的热稳定性:Z>Y>W | |
| C. | W、X能形成两种化合物,其中一种与水反应生成气体 | |
| D. | 四种元素中,Z的最高价氧化物对应的水化物酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
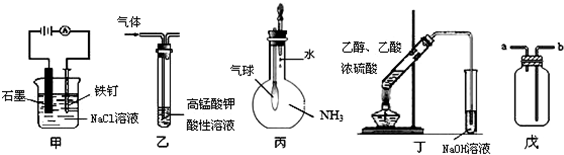
| A. | 只有③④ | B. | 只有③⑤ | C. | 只有①③⑤ | D. | 只有①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
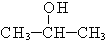 +O2$→_{△}^{催化剂}$2
+O2$→_{△}^{催化剂}$2 +2H2O,产物不发生银镜反应;
+2H2O,产物不发生银镜反应; +H2$→_{△}^{催化剂}$
+H2$→_{△}^{催化剂}$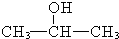 .
.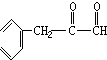 ,G与M是由不同方式形成的高分子化合物.
,G与M是由不同方式形成的高分子化合物.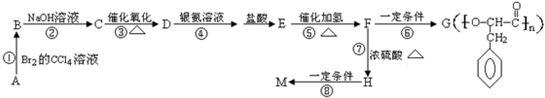
 .
.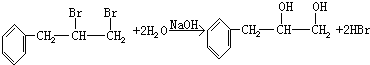 ,取代反应;
,取代反应; ,加聚反应.
,加聚反应.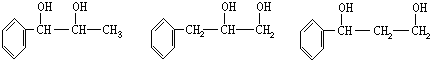
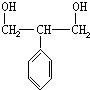 ,
,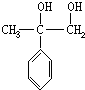 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com